
回答下列氯气的相关问题:
(1)将紫色石蕊试液滴入新制的氯水,现象是 ,起作用的微粒是 .
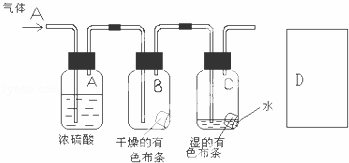
(2)某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓硫酸的作用是 .与研究目的直接相关的实验现象是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 .请在图D处以图的形式表明克服事故隐患的措施,写出化学方程式 .
(3)漂白粉是用Cl2与石灰乳反应来制取的,制取反应的化学方程式为 .漂白粉在空气中保存不当能失效,请用方程式表示原理 .
考点: 探究氯水、氯气的漂白作用;氯气的化学性质.
分析: 本实验的目的是探究氯气具有漂白性的条件下,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收氯气.
解答: 解:(1)新制的氯水中含HCl、HClO,则石蕊试液滴加到新制的氯水中,石蕊遇酸变红色,然后被HClO漂白,则观察到褪色,即溶液先变红后褪色,故答案为:溶液先变红后褪色;HCl和HClO;
(2)①本实验为对比实验,将氯气分别于 干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,故答案为:探究氯气具有漂白性的条件;
干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,故答案为:探究氯气具有漂白性的条件;
②浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体C中的水的作用,燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,
故答案为:吸收气体A中的水;B干燥布条不褪色,C湿润的布条褪色;
③氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收多余的氯气,其反应的方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,氯气有毒,应进行尾气处理,不能随意排放到空气中,应加尾气处理装置,如图 ,
,
故答案为:没有尾气处理装置,造成环境污染;Cl2+2NaOH=NaClO+NaCl+H2O; ;
;
(3)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
漂白粉久置空气中,与水、二氧化碳反应生成碳酸钙和次氯酸,次氯酸分解而使其漂白失效,发生的反应为CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO 2HCl+O2↑,
2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;CO2+Ca(ClO)2+H2O=CaCO3+2HClO;2HClO 2HCl+O2↑.
2HCl+O2↑.
点评: 本题考查氯气的漂白性的探究实验,注意氯气与氯水性质的区别以及漂白粉变质的化学反应,把握强酸制取弱酸的反应原理及HClO的不稳定性为解答的关键,注意反应方程式的书写,题目难度不大.


科目:高中化学 来源: 题型:
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是()
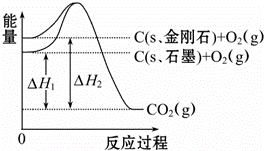
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol﹣1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的能量比1 mol金刚石的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学方程式错误的是 ( )。
A.Ca(HCO3)2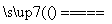 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
B.Mg(HCO3)2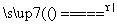 MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
C.MgCO3+H2O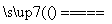 Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑
D.CaCO3+H2O===Ca(OH)2+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣浓度最大的是()
A. 1L 0.1mol•L﹣1的KCl溶液
B. 0.2L 0.1mol•L﹣1的盐酸溶液
C. 0.1L 0.1mol•L﹣1的AlCl3溶液
D. 0.3L 0.1mol•L﹣1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能够大量共存的是()
A. pH=0的溶液中:Fe3+、Mg2+、Cl﹣、SO42﹣
B. 能与铝反应生成氢气的溶液中:K+、HC03﹣、Cl﹣、S2﹣
C. 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、N03﹣、SO42﹣
D. 在A1C13溶液中:Na+、﹣、SO42﹣、N03﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与100ml 1mol•L﹣1AlCl3溶液中Cl﹣相等的是()
A. 150ml 1 mol•L﹣1氯化钠溶液
B. 75ml 2 mol•L﹣1氯化镁溶液
C. 50ml 3mol•L﹣1氯化钾溶液
D. 200ml 1.5 mol•L﹣1氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
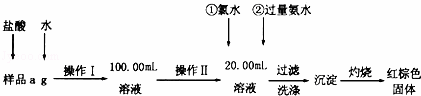
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为
(3)若不用氯水,可用下列试剂中的AC代替(填序号).
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 .
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 ×100%(请把结果约到最简).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com