
【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。
【答案】H2A=H++HA- HA-![]() H++A2- 3×10-3 mol·L-1 9×108 0.6% CN-+CO2+H2O===HCO3-+HCN 9.9×10-7 mol·L-1 b×10-7/(a-b)
H++A2- 3×10-3 mol·L-1 9×108 0.6% CN-+CO2+H2O===HCO3-+HCN 9.9×10-7 mol·L-1 b×10-7/(a-b)
【解析】
(1)根据溶液中存在的粒子种类进行分析;
(2)根据醋酸的电离平衡常数,计算此时溶液中醋酸电离出的氢离子浓度和水电离出的氢离子浓度;
(3)根据H2CO3、HCN、HCO3的酸性强弱进行分析;
(4)根据电荷守恒进行分析;
(5) K= c(CH3COO-) c(H+)/c(CH3COOH),计算出各个量的浓度,表示出K;
(1)由于二元酸H2A溶液中存在HA-,不存在H2A分子,则说明H2A为强酸,HA-为弱酸,故其电离方程式为:H2A=H++HA- ;HA-![]() H++A2-;
H++A2-;
(2)醋酸中存在电离平衡,则c(CH3COO-)=c(H+)=![]() mol/L,根据醋酸的电离平衡常数表达式可得到0.5mol/L的醋酸电离出的c(H+)为
mol/L,根据醋酸的电离平衡常数表达式可得到0.5mol/L的醋酸电离出的c(H+)为![]() =3×10-3 mol/L,水电离产生的氢离子浓度为1014/3×10-3mol/L,则由醋酸电离出的c(H+)约为水电离出的c(H+)的9×108倍;
=3×10-3 mol/L,水电离产生的氢离子浓度为1014/3×10-3mol/L,则由醋酸电离出的c(H+)约为水电离出的c(H+)的9×108倍;
(3)酸性强弱顺序为H2CO3>HCN>HCO3,所以向氰化钠溶液中通入少量二氧化碳的离子方程式为CN-+CO2+H2O= HCO3+HCN;
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒关系有c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(CH3COO-)-c(Na+)=10-6mol/L-10-8mol/L=9.9×10-7molL-1;
(5)将a mol·L-1的醋酸溶液与b mol·L-1的氢氧化钠溶液等体积混合,溶液呈中性,说明醋酸过量,醋酸和氢氧化钠溶液发生反应生成醋酸钠和水,溶液中c(CH3COOH)= (a-b)/2 molL-1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7molL-1,c(Na)=c(CH3COO-)=b/2 molL-1,则K= c(CH3COO-) c(H+)/c(CH3COOH)= b×10-7/(a-b);


科目:高中化学 来源: 题型:
【题目】表示细胞四种有机物的组成,依据主要功能,分析回答:
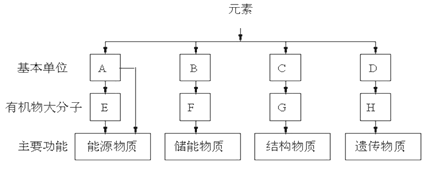
(1)A是指______;E在动物中是指_________,植物中主要是指_________。
(2)F是指_____,它是由B(脂肪酸和甘油)形成的;除此之外,脂质还包括_____和_____。
(3)C是指________;通式是__________,C形成G过程的反应叫_________。
(4)D是指_________,D形成____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | E | H | F | I | ||||
3 | A | C | D | G | R | |||
4 | B |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的是_____(离子或共价)化合物。并用电子式表示该化合物的形成过程_____
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列几组物质中,互为同位素的有__________,互为同素异形体的有__________,互为同系物的有__________,互为同分异构体的有__________,属于同种物质的__________。
①O2和O3 ②35Cl和37Cl③CH3CH3和CH3CH2CH3④CH3CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
⑤H2、D2和T2⑥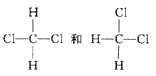 ⑦CH3(CH2)2CH3和(CH3)2CHCH3 ⑧CH3CH(CH3)CH和CH(CH3)3
⑦CH3(CH2)2CH3和(CH3)2CHCH3 ⑧CH3CH(CH3)CH和CH(CH3)3
(2)含有10个及10个以下碳原子的烷烃,其一氯代物只有一种的共有4种,请写出这4种烷烃的结构简式和名称:_______、_______、______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+![]() CO(g)═
CO(g)═![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H2
CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为__________(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为__________,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为__________(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)CH4(g)+H2O(g)△H<0.在T℃,106Pa时将lmolCO和3molH2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断CO(g)+3H2(g)![]() CH4(g)+H2O(g)达到平衡的是__________(填序号).
CH4(g)+H2O(g)达到平衡的是__________(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为__________;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为__________;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是__________,理由是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V mL Al2(SO4)3溶液中含有Al3+ a g,取0.5V mL溶液稀释到8V mL,则稀释后溶液中SO42-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com