
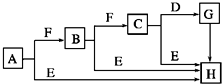
 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;
;分析 A为单质,A能与F发生连续反应生成C,C的相对分子质量为78,可推知A为Na,F为O2,B为Na2O,C为Na2O2,E在常温下为液体,则E为H2O,钠与水、氧化钠与水、过氧化钠与水都产生氢氧化钠,所以H为NaOH,D是一种气体,则D为CO2,与过氧化钠反应生成G为Na2CO3,G与氢氧化钙反应生成氢氧化钠,符合各物质的转化关系,据此答题.
解答 解:A为单质,A能与F发生连续反应生成C,C的相对分子质量为78,可推知A为Na,F为O2,B为Na2O,C为Na2O2,E在常温下为液体,则E为H2O,钠与水、氧化钠与水、过氧化钠与水都产生氢氧化钠,所以H为NaOH,D是一种气体,则D为CO2,与过氧化钠反应生成G为Na2CO3,G与氢氧化钙反应生成氢氧化钠,符合各物质的转化关系,
(1)A为Na,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)A.Na2O2久置于空气中会变成生成碳酸钠,为白色固体,故A正确;
B.Na2O2具有强氧化性,故B正确;
C.Na2O2晶体中存在离子键与共价键,故C正确;
D.Na2O2不是一种碱性氧化物,故D错误,
故答案为:D;
(3)C和E反应生成H的反应为Na2O2与H2O反应生成氢氧化钠与氢气,离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;1:1.
点评 本题考查无机物的推断,题目难度中等,注意掌握中学常见连续反应,基本属于猜测验证型题目,需要学生熟练掌握元素化合物中等.


科目:高中化学 来源: 题型:解答题

 ,F中的含氧官能团名称酚羟基、羧基;
,F中的含氧官能团名称酚羟基、羧基; ;
; +O2$\stackrel{Cu}{→}$2
+O2$\stackrel{Cu}{→}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
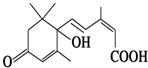 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+=SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀,这说明铁钉发生了吸氧腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com