
| A、大于20mL | B、小于20mL | C、等于20mL | D、等于5mL |
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |

查看答案和解析>>
科目:高中化学 来源:2013届湖南省怀化市高三上学期期末考试化学试卷(带解析) 题型:填空题
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50× 10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省怀化市高三上学期期末考试化学试卷(解析版) 题型:填空题
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.50× 10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH 0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)= 。
(3)该温度下,反应的平衡常数K= 。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。
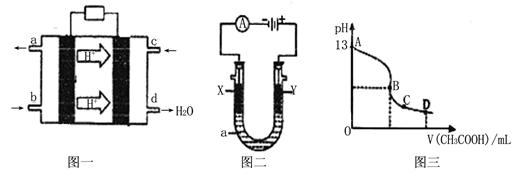
(1)该电池正极的电极反应式为 。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式 。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 ) 。
查看答案和解析>>
科目:高中化学 来源:四川省期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com