
P
和[
]A
.5∶4 B.4∶3 C.5∶3 D.1∶1 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
 在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题:
在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(Mpa) | ||||
| Ⅰ | 150 |
|
0.1 | ||||
| Ⅱ | 150 150 |
|
5 | ||||
| Ⅲ | 350 |
|
5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 550°C |
| ||
| 550°C |
| 实验编号 | T/℃ | 平衡时压强P/MPa | 起始用量/mol | 平衡时CO的转化率 | 放出热量/kJ | |
| n(H2) | n(CO) | |||||
| Ⅰ | 250 | 2 | 20 | 10 | 90% | a |
| Ⅱ | 250 | P1 | 40 | 20 | c | b |
| 250°C |
| 2MPa |
| a |
| 9 |
| 250°C |
| 2MPa |
| a |
| 9 |
查看答案和解析>>
科目:高中化学 来源:2013届湖北省部分重点中学高三秋季期中联考化学试卷(带解析) 题型:单选题
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是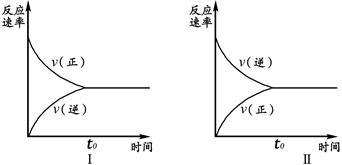
| A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L. |
| B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。 |
| C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。 |
| D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三秋季期中联考化学试卷(解析版) 题型:选择题
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是
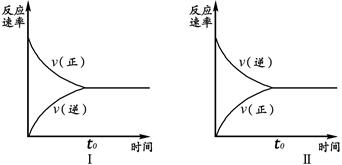
A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L.
B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。
C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。
D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。
查看答案和解析>>
科目:高中化学 来源:2012年北京市东城区高考化学综合练习试卷(一)(解析版) 题型:填空题
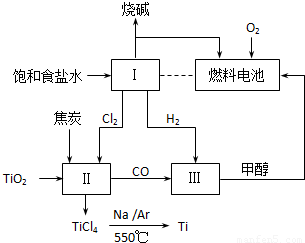
| 实验编号 | T/℃ | 平衡时压强P/MPa | 起始用量/mol | 平衡时CO的转化率 | 放出热量/kJ | |
| n(H2) | n(CO) | |||||
| Ⅰ | 250 | 2 | 20 | 10 | 90% | a |
| Ⅱ | 250 | P1 | 40 | 20 | c | b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com