
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )
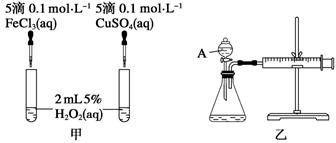
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高一下学期期末考试化学试卷(带解析) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: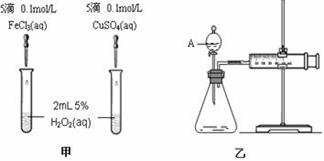
(1)定性分析:如图甲可通过观察 现象,定性比较得出结论。有同学提出将Cu SO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。
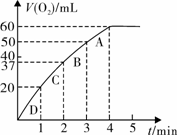
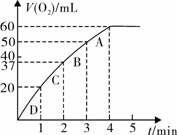
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①实验时放出气体的总体积是 mL。
②A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
③解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期期末考试化学试卷(解析版) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察 现象,定性比较得出结论。有同学提出将Cu SO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①实验时放出气体的总体积是 mL。
②A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
③解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期第一次统练化学试卷 题型:填空题
(14分) 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO、CO、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 (填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B。当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴入稀HNO3沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 (填序号)。
A.SO B.SO C.CH3COO- D.SiO
②A中的化学键类型为 。
③B的水溶液中所有离子的浓度由大到小的顺序为 (用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为
g(精确到0.1 g)。
⑤利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 。
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙同学分别设计了如图一、图二所示的实验。
(1) H2O2分解的化学方程式为 。
 |
图一 图二
(2)图一所示实验能定性说明反应快慢的依据是 _______________________________;
图二所示实验能说明反应快慢的数据是____________________________________。
(3)① 用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H= + 64.39 kJ/mol
2H2O2(l)=2H2O(l) + O2(g) △H= ﹣196. 46 kJ/mol
H2(g) + 1/2O2(g) = H2O(l) △H= ﹣285. 84 kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为:
。
② 控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol/L H2SO4的混
合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 (×10—3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com