

 NH3?H2O + H+ (2��)
NH3?H2O + H+ (2��) NH3?H2O + H+��
NH3?H2O + H+��

 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���õ�ⷨ������ͭ��ʱ��ͭ������ |
| B����þ���������ˮ�����������Է�ֹ������ʴ |
| C�������ռ��ʱ����ʹ��ʯӢ���� |
| D���������������CO2�кͼ��Է�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
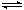 CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���
CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���| ��ѧ�� | C��C | C��H | H��H | C��O | C=O | H��O |
| ����/kJ��mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ͼlΪij�������ʾ�����ԭ�ӵĶѻ���ʽ�����侧������Ϊ�������� |
| B��ͼ2Ϊ��բ�ŵķ���ԭ��ʾ��ͼ�����բ��Ӧ���Դ���������� |
| C��ͼ3��ʾCH3COOH��Һ�м�ˮʱ��Һ�ĵ����Ա仯����CH3COOH��Һ��pH��a>b |
| D��ͼ4��ʾ���ݻ���ͬ�ĺ����ܱ������У�������N02�ڲ�ͬ�¶��·�Ӧ�� |
 N204(g)����ͬʱ�����N02���������ߣ���÷�Ӧ�ġ�H<O
N204(g)����ͬʱ�����N02���������ߣ���÷�Ӧ�ġ�H<O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ������ɫ���ľ��壬����������̫���ܵ�� |
| B������0.1 mol/LNaCl��Һ��������ʱ���ӣ���������ҺŨ��ƫС��������������ȷ�� |
| C����ˮ�м���������������ƶ���ʹˮ�ĵ���ƽ�������ƶ���ˮ�����ӻ����� |
| D����֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H="+74.9" kJ��mol-1����˸÷�Ӧһ�������Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2(g)+2H2O(l) ��H="-a" kJ/mol
N2(g)+2H2O(l) ��H="-a" kJ/mol CuO(s)+H2O(l) ��H="b" kJ/mol
CuO(s)+H2O(l) ��H="b" kJ/mol 2Cu2O(s)+O2(g) ��H="c" kJ/mol
2Cu2O(s)+O2(g) ��H="c" kJ/mol Cu2O+H2������������ӦʽΪ�� ��
Cu2O+H2������������ӦʽΪ�� ��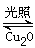 2H2(g)��O2(g) ��H����484 kJ��mol��1
2H2(g)��O2(g) ��H����484 kJ��mol��1| ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
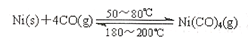

 ��3����ҵ����һ����̼��ȡ�����ķ�ӦΪ��CO��g��+H2O CO2(g)+H2��g������֪420��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ9.0�������Ӧ��ʼʱ����2L���ܱ������г���CO��H2O�����ʵ�������0.60mol,5minĩ�ﵽƽ�⣬���ʱCO��ת����Ϊ ��H2��ƽ����������Ϊ ��
��3����ҵ����һ����̼��ȡ�����ķ�ӦΪ��CO��g��+H2O CO2(g)+H2��g������֪420��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ9.0�������Ӧ��ʼʱ����2L���ܱ������г���CO��H2O�����ʵ�������0.60mol,5minĩ�ﵽƽ�⣬���ʱCO��ת����Ϊ ��H2��ƽ����������Ϊ ��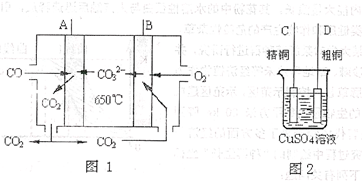
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H��
CH3OH(g) ��H��
| A�����������ƶ� | B�����淽���ƶ� | C������ƽ��״̬ | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڻ�ѧ��Ӧ�����У��������ʱ仯��ͬʱ��һ�����������仯 |
| B����101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)=2H2O(l)����H����571.6 kJ/mol |
| C���¶ȡ�Ũ�ȵĸı�һ��������Ӧ���ʵĸı䣬���Ի�ѧƽ��һ�����ƶ� |
| D������Һ�д���c(H��)��c(OH��)��10��6 mol/L�������Һһ�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com