
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
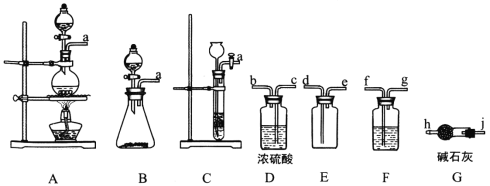
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
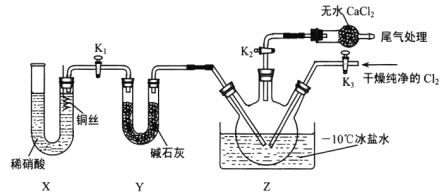
①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
【答案】A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 ![]() %
%
【解析】
(1)由二氧化锰与浓盐酸加热(或高锰酸钾与浓盐酸)制备氯气,根据反应条件选择可得;
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,据此分析可得;
(3)X制备NO气体,Y干燥NO气体,干燥的NO与氯气在Z中反应,
①X装置的优点是可以排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气;
(4)已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,利用Ag2CrO4为砖红色沉淀来指示反应达到终点,氯元素守恒:ClNO~HCl~AgNO3,结合化学方程式定量关系计算亚硝酞氯(ClNO)的质量分数。
(1)制取氯气可以用二氧化锰与浓盐酸加热或高锰酸钾与浓盐酸反应制得,选择A,发生的离子反应为:MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl
Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,为保证除杂彻底,导气管均长进短出,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,故导气管连接顺序为a→f→g→c→b→d→e→j→h,装置F→D→E→G,故答案为:F;D;E;G;
(3)①用B装置制备NO,与之相比X装置可以排除装置内空气的干扰;可以随开随用,随关随停,故答案为:排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气,故答案为:排干净三颈瓶中的空气;
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点,
根据氯元素守恒:ClNOHClAgNO3,
11
ncmol/L×20.00×103L×![]()
n=cmol/L×20.00×103L×![]() =c×20.00×103×10mol=0.2c mol,
=c×20.00×103×10mol=0.2c mol,
亚硝酞氯(ClNO)的质量数=![]() ×100%=
×100%=![]() %,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;
%,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;![]() %。
%。


科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
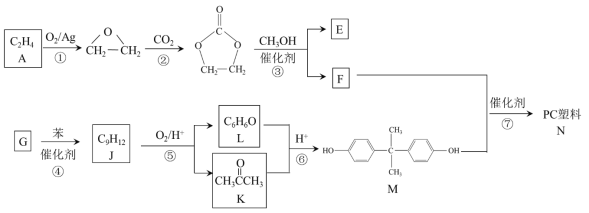
已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法不正确的是( )
A.在离子晶体中,正、负离子半径比(![]() )越大,晶体的配位数越大
)越大,晶体的配位数越大
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,阴、阳离子配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2的高主要是因为MgO中的离子键比MgCl2中的离子键强
D.金属晶体和离子晶体都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究化合物A(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
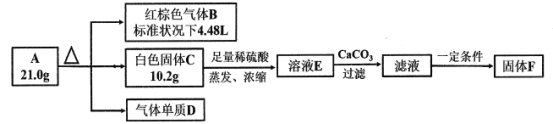
已知:白色固体C既能与强酸反应,也能与强碱反应。
请回答:
(1)写出A受热分解的化学方程式为___________________________________________。
(2)请设计实验方案检验溶液E中所含的阳离子_________________________________。
(3)若固体F中金属元素的百分含量为19.29%,硫为22.86%,氧为57.14%,且300 g/mol<MF<450 g/mol,则F的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:主反应:
a.4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:b.4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
c.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①上述反应中利用了NH3的__________性质;ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图1,试分析脱硝的适宜温度是______(填序号)。
A.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_____________________________________。
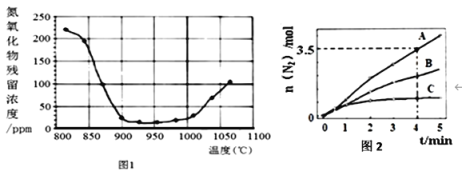
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.8k·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,v正___v逆(填“>”“<”或“=”)。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(分数表示)。
=___________。(分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
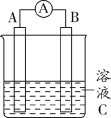
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为_____________;反应进行一段时间后溶液C的pH将_____(填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(负极)极材料为____,B(正极)极材料为______,溶液C为_______。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
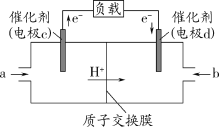
电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是____(填“正极”或“负极”),c电极的反应方程式为______________。若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO![]() =HCO
=HCO![]()
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O==HClO+HCO3-
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-==Mn2++Cl2↑+2H2O
C. 向澄清的石灰水中通入过量的CO2:CO2 + OH- == HCO3-
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com