

(1)写出废铁屑与盐酸反应的离子方程式:
①__________________________________;____________________________________。
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
编号 | 实验内容 | 实验操作 | 预期现象和结论 |
① | 检验黄色溶液A中是否含有Fe2+ |
|
|
② | 检验绿色溶液C中是否含有Fe3+ |
|
|
(3)电解时阴极材料是____________。
(4)采用排液法收集氯气,该液体是____________。
(1)①Fe2O3+6H+![]() 2Fe3++3H2O ②2Fe3++Fe
2Fe3++3H2O ②2Fe3++Fe![]() 3Fe2+
3Fe2+
(2)
编号 | 实验内容 | 实验操作 | 预期现象和结论 |
① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色,则黄色溶液A含有Fe2+ |
② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 | 溶液出现血红色,则绿色溶液C含有Fe3+ |
(3)纯铜(粗铜不可)
(4)饱和食盐水
解析:本题考查元素铁和铜的性质,以流程图的形式展示,涉及离子方程式的书写、Fe2+和Fe3+的检验、电解精炼铜以及氯气的收集等知识点。(1)离子方程式的书写考查同学们的基础知识;第(2)问是检验Fe2+和Fe3+的问题,Fe2+可以使酸性高锰酸钾溶液褪色;Fe3+的常用检验方法是用KSCN能变血红色这一特殊现象;(3)电解精炼铜是用纯铜作阴极;(4)Cl2在饱和食盐水中的溶解度小,因而可以用排饱和食盐水的方法来收集氯气。此题只要基础牢固就可顺利得出答案。


科目:高中化学 来源: 题型:阅读理解



| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | ||
| ② | 检验绿色溶液C中是否含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
①将洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
②按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④试剂瓶B中的溶液经过一系列操作,可得FeCl3·6H2O晶体。
请回答下列问题:

(1)A中的X极应连接电源的___________极,A中发生的化学反应方程式为_____________;B中溶液颜色变化为______________。
(2)C烧杯中应盛放的试剂是______________,其作用是__________________________。
(3)试剂瓶B中的溶液由步骤④制得FeCl3·6H2O晶体,则步骤④需要进行的操作依次是(填序号)______________。
A.加热浓缩 B.洗涤、干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是__________________________。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 2.2 物质的制备练习卷(解析版) 题型:填空题
铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。已知X中铁、碳的元素质量比为14∶1。X的最简式为__________。
(2)X有下列转化关系:(无关物质已经略去)

溶液甲中含有的大量阳离子是________________;溶液甲中加入H2O2发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z__________、W__________。
(4)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们:________________________。
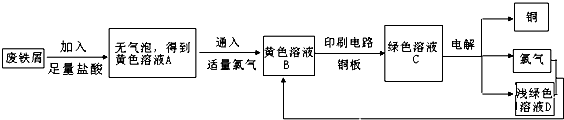
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:

①写出废铁屑与盐酸反应的离子方程式:
________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
实验内容 |
实验操作 |
预期现象和结论 |
|
检验黄色溶液A中是否含有Fe2+ |
|
|
|
检验绿色溶液C中是否含有Fe3+ |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com