
| A. | 9.2g | B. | 8.6g | C. | 8g | D. | 7.4g |
分析 求出所需的氯化钠的质量m=m液×ω%,根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算.
解答 解:8.6%的氯化钠溶液100g,所需的氯化钠的质量m=100g×8.6%=8.6g.故应选用砝码8g,游码0.6g.
由于正确的称量方式是“左物右码”,当把砝码放在左盘,氯化钠放在右盘时,砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即实际称得镁粉的质量=8g-0.6g=7.4g.故选D.
点评 本题考查托盘天平的使用,题目难度不大,掌握左盘质量=右盘质量+游码质量是解答此类题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L mol/L NaCl溶液中含有Cl-约为6.02×10-23 | |
| B. | 配制一定物质的量浓度的溶液,用浓硫酸配制稀硫酸与用NaOH固体配制NaOH溶液使用的仪器是不同的 | |
| C. | 把1L 2mol/L的盐酸稀释为1mol/L的盐酸需要加入1L的蒸馏水 | |
| D. | 25℃可以配制1.0mol/L的Ba(OH)2溶液[Ba(OH)2•8H2O在293K和303K时的溶解度分别为3.9g和5.6g] |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成CO2的物质的量为2 mol | B. | 生成CO2的体积为4.48L | ||
| C. | 生成O2的体积为4.48L | D. | 生成CO2的分子数为1.204×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水和乙醇 | |
| B. | 乙二醇(沸点197.3℃)和乙酸(沸点117.9℃) | |
| C. | 氯化钠溶液和碳酸钙 | |
| D. | 碘和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下KOH的溶解度为$\frac{2a}{1-2a%}$g | |
| B. | 原溶液的质量为3mg | |
| C. | 可以求算原溶液的物质的量浓度 | |
| D. | 保持温度不变,向原溶液中加入2a g KOH可达饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
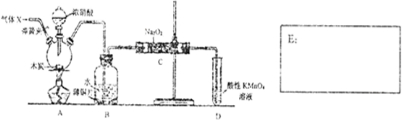
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com