
原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
A.同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大
B.可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置
C.由氟、氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸
D.在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源:2015-2016学年江苏省宝应县高一下学期期中调研联合考试化学试卷(解析版) 题型:选择题
在下列有关晶体的叙述中错误的是
A.稀有气体的原子能形成分子晶体 B.离子晶体中,一定存在离子键
C.原子晶体中,只存在共价键 D.金属晶体的熔沸点均很高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期第一次月考化学试卷(解析版) 题型:填空题
木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛 (结构简式如图)。
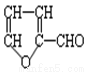
(1)木糖的结构简式为____ __,木糖不可能具有的性质是___________
A.水解反应 B.还原反应 C.氧化反应 D.取代反应 e.加成反应 f.酯化反应
(2)形成糠醛的过程中,1分子木糖脱去了___________分子水。
(3)写出木糖与氢气加成反应的化学方程式______________________________________________。
所得产物称为木糖醇,它是一种理想的蔗糖替代品,适合糖尿病患者食用,原因是________(填编号)。
A.木糖醇不受酵母菌和细菌作用,能防龋齿
B.木糖醇是多羟基化合物,易溶于水
C.木糖醇没有蔗糖甜
D.木糖醇被食用后不提高血糖浓度
(4)写出糠醛被新制氢氧化铜氧化的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
原子核外P能层和p能级可容纳的最多电子数分别为( )
A.72和6 B. 50和6 C.32和2 D. 86和10
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4)Z2Y2中的化学键类型是_____________________;Z2Y2与水反应放出气体的离子方程式为
________ _____。
(5) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
已知七种短周期元素a~g的有关信息如下表所示:
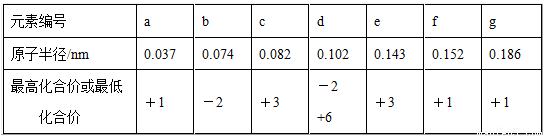
下列推断不正确的是( )
A.氢化物稳定性的强弱:b>d
B.元素e的氧化物只能与酸反应
C.金属性的强弱:f<g
D.元素a与元素d形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列反应中不可能设计成原电池的是( )
A.2Fe3++Fe===3Fe2+
B. NaOH+HCl===NaCl+H2O
C.Zn+2HCl===ZnCl2+H2↑
D.4Al+3O2+6H2O===4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________。
(4)Z与R能形成化合物甲,1mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________,________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为______ __。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为 __。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;若X晶体的密度为p g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________cm(用代数式表示)。
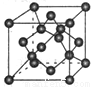
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:填空题
Ⅰ.化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳, 而氢气被认为是无碳无污染的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2 MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。
MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。

a、T1>T2
b、增大氢气压强,加快氢气的吸收速率
c、增大M的量,上述平衡向右移动
d、上述反应可实现多次储存和释放氢气
(2)在25℃,101KPa条件下,ag氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 .
(3)工业上通常用生产水煤气的方法制得氢气。其中C(s) +H2O(g)  CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
①当加热到850℃,反应达到平衡的标志有 .
A.消耗水蒸气的物质的量与生成CO的物质的量相等 B.容器内的压强不变
C.混合气的密度不变 D.单位时间有n个H﹣O键断裂的同时有n个H﹣H键断裂
②850℃时反应达到平衡,x应满足的条件是 .
Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
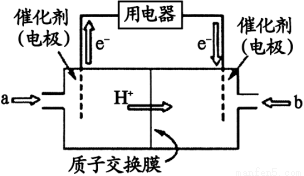
(4)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如上图所示:通入b气体的电极是原电池的 极(填 “正”或“负”)。通入a气体的电极反应式为 。
(5)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为80ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (保留两位小数,已知法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
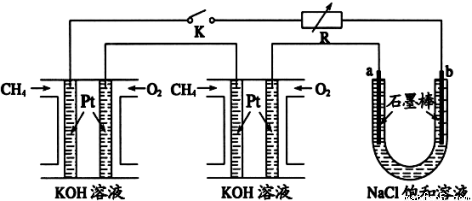
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com