
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_____。
A.Na2CO3 B.NaOH C.BaCl2
(2)将滤液的pH调至酸性除去的离子是________。
(3)下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是________,在X极附近观察到的现象是________,电解NaCl溶液的离子方程式是_________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是________。
(1)C、B、A(或B、C、A);(2)CO32-和OH-;(3)2H++2e-=H2↑有无色气泡产生,溶液变红;2Cl-+2H2O Cl2↑+H2↑+2OH-(4)NH3
Cl2↑+H2↑+2OH-(4)NH3
解析试题分析:(1)首先向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,然后向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;最后加入Na2CO3 ,发生反应Ca2++ CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是B、C、A。也可以是首先向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;然后向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,最后加入Na2CO3发生反应Ca2++CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是C、B、A。
(2)过滤后溶液中含有过量的NaOH、Na2CO3。这时向溶液中加入盐酸,发生反应:H++ OH-= H2O; CO32-+2H+=CO2↑+H2O;因此将滤液的pH调至酸性除去的离子是CO32-和OH-。
(3)在电极食盐水的装置中,与电源正极相连的Y电极为阳极,由于阴离子Cl-、OH-的放电能力Cl->OH-。所以在电极Y上发生的反应为:2Cl—--2e-=Cl2↑; 与电源负极相连的X电极为阴极,由于阳离子H+、Na+的放电能力H+>Na+。所以在电极X上发生的反应为:2H++2e-=H2↑;由于H+不断放电消耗,破坏了附近的水的电离平衡,水会继续电离直至达到新的平衡状态,最终导致附近的溶液中C(OH-)>C(H+),因此滴入几滴酚酞溶液后,在X电极附近溶液变为红色。电解NaCl溶液的离子方程式是2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(4)发生反应后的母液中含有大量的NH4Cl,若向分离出NaHCO3晶体后的母液中加入过量生石灰,会发生反应CaO+ H2O= Ca(OH)2,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
考点:考查粗盐中杂质的除去的方法、步骤及电解食盐水的反应原理、现象和物质的综合利用的知识。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:填空题
仔细分析如图装置,完成下面的填空。
(1)—段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,碳棒上有__________产生。与Zn棒相连的碳棒(C2)质量____________(填“增大”、“减小”或“不变”)。
(2)甲池Zn极为__________极,电极反应式:____________________________________,乙池中C1为__________极,电极反应式为:________________________________________,乙池总反应式为:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
该同学利用制得的CuSO4溶液及如图所示装置,进行以下实验探究。
图一 图二
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如下图所示,烧杯中都盛有稀硫酸。
①写出(3)中的电极反应:Fe: 、 Zn: 。
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98. 5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.现将反应2Fe3+ + 2I- 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池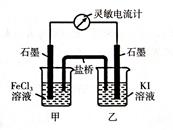
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。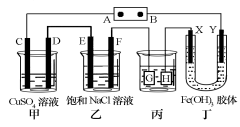
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com