
����Ŀ����(N)����(P)����(As)��VA��Ԫ�ػ��������о�������������Ҫ��;�����ҹ�������Ա�о�����As2O3(��д��As4O6���׳���˪)��Ѫ�������Ե��������ûش��������⣺
��1��Asԭ�ӵĺ�������Ų�ʽΪ_________________��P�ĵ�һ�����ܱ�S���ԭ��Ϊ_______________
��2��д��һ����CN����Ϊ�ȵ����������________(�û�ѧʽ��ʾ)��(SCN)2����������������������Ϊ___________
��3����˪�綾������ʯ����������AsO33-������AsO43-������AsO33-��As���ӻ���ʽΪ__________��AsO43-�Ŀռ乹��Ϊ___________
��4��NH4+��HһNһH�ļ��DZ�NH3��H һNһH�ļ��Ǵ��ԭ����__________��NH3��ˮ������ͭ�����γɵĻ������������ӳ����������İ�����ṹ(����ͼI)���û��������ʱ����ʧȥˮ�����ԭ�ӽṹ�Ƕȼ��Է�����__________
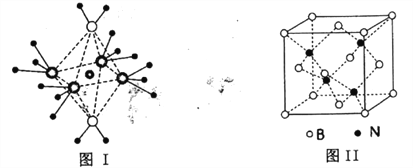
��5��BN���۵�Ϊ3000�����ܶ�Ϊ2.25g��cm-3���侧���ṹ����ͼ����ʾ��������һ��Bԭ����Χ���������Nԭ����__________������ԭ�Ӱ뾶�ֱ�ΪrNpm��rBpm�������ӵ�����ֵΪNA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ__________
���𰸡� 1s22s22p63s23p63d104s24p3��[Ar]3d104s24p3 P��p�ܼ��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ���� CO��N2 5:4 sp3 �������� NH4+�еĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų���������NH4+��H-N-H�ļ��DZ�NH3�д� ����Oԭ�Ӱ뾶С���縺�Դ��ṩ�¶Ե���������Nԭ��������ˮ�����γɵ���λ�����ڰ����� 4 ![]()
��������������������⿼��ԭ�Ӻ�������Ų�ʽ����д����һ�����ܵıȽϣ��ȵ����壬�Ҽ��ͦм����жϣ��ӻ���ʽ�Ϳռ乹�͵��жϣ�����ķ����ͼ��㡣
��1��Asԭ�Ӻ�����33�����ӣ����ݹ���ԭ����Asԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s24p3��[Ar] 3d104s24p3��P��S�����ڵ������ڣ�S�ļ۵����Ų�ʽΪ3s23p4��P�ļ۵����Ų�ʽΪ3s23p3��P��3p�ܼ����ڰ�������Ƚ��ȶ���P�ĵ�һ�����ܱ�S�Ĵ�
��2�����������������CN-��Ϊ�ȵ������������CO��N2��C22-������SCN��2�ĽṹʽΪN![]() C��S��S��C
C��S��S��C![]() N������ȫ�ǦҼ�����������1���Ҽ���2���м�����SCN��2��������5���Ҽ���4���м����Ҽ��ͦм�������Ϊ5:4��
N������ȫ�ǦҼ�����������1���Ҽ���2���м�����SCN��2��������5���Ҽ���4���м����Ҽ��ͦм�������Ϊ5:4��
��3��AsO33-��As�ϵŵ��Ӷ���=![]() ��5+3-3
��5+3-3![]() 2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=
2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=![]() ��5+3-4
��5+3-4![]() 2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ����������
2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ����������
��4��NH4+��H��N��H�ļ��DZ�NH3��H��N��H�ļ��Ǵ��ԭ���ǣ�NH4+�еĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų���������NH4+��H-N-H�ļ��DZ�NH3�д���NH3��ˮ������ͭ�����γɵĻ������������ӳ����������İ�����ṹ���û��������ʱ����ʧȥˮ��˵��ˮ������Cu2+�γɵ���λ������NH3������ԭ������Oԭ�Ӱ뾶С���縺�Դ��ṩ�¶Ե���������Nԭ��������ˮ������Cu2+�γɵ���λ�����ڰ�������
��5��������̯������B��8![]() +6
+6![]() =4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4
=4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��pm3=4
��rB3��pm3=4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g
10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g![]() 2.25g/cm3�����������Ϊ4
2.25g/cm3�����������Ϊ4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4
NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3
10-30cm3![]() [4
[4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA��]=
NA��]=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵͼ��
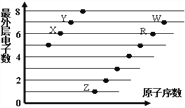
����˵������ȷ����
A. ��̬�⻯��е㣺X��Y��R
B. ���Ӱ뾶��R��X��Y��Z
C. ��̬�⻯����ȶ��ԣ�Y��X��W��R
D. X��Z�γɵĻ�������ֻ�����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
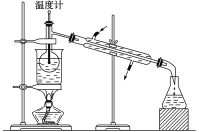
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ��,�����װ�ûش�����:
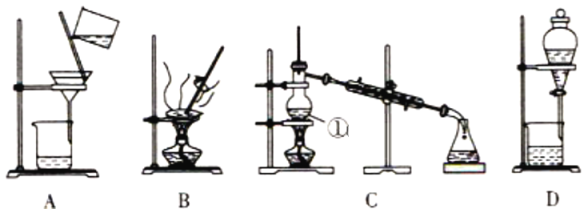
��1����װ��A��װ��B�ж��õ�������,װ��A�в�������������__________,װ��B�в�������������__________,��ֹ����������Һ��ֲ����ȶ�������
��2��װ��C�Тٵ�������__________,���м����ʯ��������__________,��ȴˮ�ķ�����__________��װ��D�ڷ�ҺʱΪʹҺ��˳������,Ӧ���еľ��������__________��
��3�����Ȼ�����Һ�еõ��Ȼ��ƹ���,ѡ��װ��__________(�����װ��ͼ����ĸ,��ͬ);��ȥ����ˮ�е�Cl-������,ѡ��װ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ʵ�������ʵ����۾���ȷ����
ѡ�� | ʵ����� | ʵ������ | ʵ����� |
A | ��һ��Ũ��CuSO4��Һ��ͨ��H2S���� | ���ֺ�ɫ���� | H2S���Ա�H2SO4ǿ |
B | �����£���ͬ��Ƭ�ֱ�Ͷ������ϡ��Ũ������ | Ũ��������Ƭ���ܽ��� | ��Ӧ��Ũ��Խ��Ӧ����Խ�� |
C | 2mL0.1mol��L-1MgCl2��Һ�еμ�2��1mol��L-1NaOH��Һ���ٵμ�2��0.1mol��L-1FeCl3��Һ | �����ɰ�ɫ�����������ɺ��ɫ���� | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
D | ��2mL2%CuSO4��Һ�м��뼸��1%NaOH��Һ������뼸���л�������Һ������ | δ����ש��ɫ���� | ���������������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���168O��������ȷ����
A. ������Ϊ8 B. ������Ϊ16 C. ������Ϊ8 D. ������Ϊ16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�鷨��ѧϰ��ѧ����Ҫ������
�������к��зḻ�ĵ�Ԫ�أ��Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ�����������(��֪2I-��Cl2=2Cl-��I2��������һ���������л��ܼ�)��
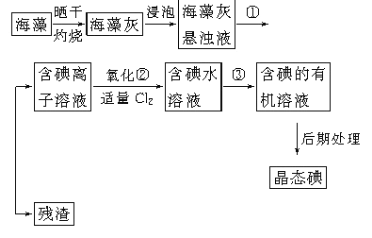
��1��ʵ������ٵ����ƣ�___________________ ��
��2��ʵ�鲽����м�����Cl2��Ŀ����______________________________��
��3��ʵ�鲽�����ȡ��Ĺ����У�����ѡ�õ��ܼ���________��
A���� B���ƾ� C�����Ȼ�̼
��4���Ӻ��忪ʼ����5��������������л���Һ��ʵ���������Ҫ�õ�����ʵ����������֪ʵ������������������ǯ���ձ������������ƾ��ơ�ʯ�������Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ���������__________________��________________��
��5���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������辭������ָ����ͼ��ʾʵ��װ���еĴ���֮����_________________��_________________��__________________��
��ijѧ�����������ʵ�鷽������NaCl��CaCl2���ֹ�������:
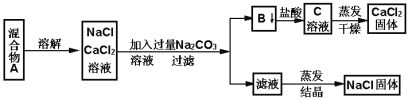
��պͻش���������
��1��д������B���ʵĻ�ѧ����ʽ________________
��2����Һ�е�������_____________________��д��ѧʽ������Ҫ�Ƶô�����NaCl��Ӧ����Һ�м���������ij���Լ������Լ���������_________________ ��
��3����Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ���һ���ʵ�����������������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.1L K2SO4��MgSO4�Ļ����Һ�У���Mg2+ 2.4g��SO42�������ʵ���Ũ��Ϊ1.5mol/L����MgSO4��K2SO4�����ʵ���Ũ�ȣ�_____________
��2�������£���20.0g��������Ϊ14.0%��KNO3��Һ��30.0g��������Ϊ24.0%��KNO3��Һ��ϣ��õ����ܶ�Ϊ1.15g/cm3�Ļ����Һ�����㣺
�ٻ�Ϻ���Һ������������_________
�ڻ�Ϻ���Һ�����ʵ���Ũ�ȣ�________
����1000gˮ�����ܽ����Ħ��KNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȣ�_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӱ�������ڿ�Ч�����������ʿ��������������ά����
A.�մ�B.��������C.ʯīϩD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�����������ȷ����
A.ֻ�����������вŴ���̼̼����B.���е���������ȼ��
C.����ͨʽΪCnH2n+2����������������Ҳ������ϩ��D.��ϩ���⣬������������ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com