
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:
(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 , E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
(共10分)
(1)氢键 Na+[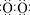 ]2-Na+ (2)①acb ②正四面体 ③-990.7kJ/mol (每空2分)
]2-Na+ (2)①acb ②正四面体 ③-990.7kJ/mol (每空2分)
解析试题分析:A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,则符合条件的是水和双氧水,因此A是H,D是O。B的外围电子数为内层电子数的两倍,则B是碳元素。B、C、D的原子序数依次增大,属于C是N元素。E也能与D按原子个数比1﹕1或2﹕l形成化合物,且A与E属于同一主族,所以E是Na。B与F同主族,且F是短周期元素,因此F是Si元素。
(1)根据结构图可知,H和O形成的化合物是水分子。水分子间存在氢键,因此虚线表示的是氢键。Na和O形成个数比为1︰1的化合物是过氧化钠,其电子式是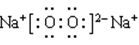 。
。
(2)①F与B形成的化合物形成的化合物是SiC,属于原子晶体;B与D形成的稳定化合物是CO2,形成的晶体是分子晶体;F的单质是硅,形成的晶体也是原子晶体。根据Si-Si和C-Si键的键能可知,SiC中共价键强于单质Si中的共价键,所以SiC的熔点高于单质硅的,即答案是acb。
②单质硅的结构类似于金刚石的,所以单质晶体中一个F原子与其紧邻的F原子形成的空间构型为正四面体型。
③单质硅中平均一个硅原子形成2个Si-Si键。而二氧化硅晶体中平均一个硅原子形成4个Si-O键,所以根据化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差可知,该反应的反应热△H=176kJ/mol×2+497.3 kJ/mol-460 kJ/mol×4=-990.7 kJ/mol。
考点:考查氢键的判断、电子式的书写、熔点高低比较、分子结构的判断以及反应热的计算
点评:该题是基础性试题的考查,试题难易适中。考查的知识点比较基础,侧重对学生能力的考查。该题的难点在于反应热的计算,因为需要学生首先判断晶体硅和二氧化硅中化学键与硅原子个数的关系。本题有利于培养学生严谨的逻辑思维能力,以及规范答题能力,提高学生的学习效率。


科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
32 16 |
32 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com