
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
分析 (1)25℃时,0.05mol•L-1Ba(OH)2溶液中c(OH- )=0.05×2=0.1mol/L,该溶液中c(H+ )=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+ );
将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,溶液呈中性,说明酸中n(H+ )等于碱中n(OH- );
(2)①HCOONa是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性;
②酸的电离平衡常数越大,该酸的电离程度越大,酸的酸性越强,相应的酸根离子水解程度越小,根据电离平衡常数知,酸的电离平衡常数HCOOH>H2CO3>HClO>HCO3-,则酸根离子水解程度大小顺序是CO32->HClO->HCO3->HCOO-,酸根离子水解程度越大,相同浓度的钠盐溶液pH越大;
(3)温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的HCOOH和HCOONa,所得溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度;
(4)处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则溶液中c3(OH- )=$\frac{{K}_{sp}[Fe(OH)_{3}]}{c(F{e}^{3+})}$,残留的Cr3+的浓度=$\frac{{K}_{sp}[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$.
解答 解:(1)25℃时,0.05mol•L-1Ba(OH)2溶液中c(OH- )=0.05×2=0.1mol/L,该溶液中c(H+ )=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+ )=13;
将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,溶液呈中性,说明酸中n(H+ )等于碱中n(OH- ),设氢氧化钡的体积为xL、HCl的体积为yL,
则0.1x=0.01y,x:y=1:10,
故答案为:13;1:10;
(2)①HCOONa是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,离子方程式为HCOO-+H2O?HCOOH+OH-,
故答案为:HCOO-+H2O?HCOOH+OH-;
②酸的电离平衡常数越大,该酸的电离程度越大,酸的酸性越强,相应的酸根离子水解程度越小,根据电离平衡常数知,酸的电离平衡常数HCOOH>H2CO3>HClO>HCO3-,则酸根离子水解程度大小顺序是CO32->HClO->HCO3->HCOO-,酸根离子水解程度越大,相同浓度的钠盐溶液pH越大,所以这几种钠盐溶液的pH大小顺序是a>b>d>c,
故答案为:a>b>d>c;
(3)温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的HCOOH和HCOONa,所得溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,即HCOOH的电离程度大于HCOONa的水解程度,
故答案为:大于;
(4)处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则溶液中c3(OH- )=$\frac{{K}_{sp}[Fe(OH)_{3}]}{c(F{e}^{3+})}$,残留的Cr3+的浓度=$\frac{{K}_{sp}[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{6.0×1{0}^{-31}}{\frac{4.0×1{0}^{-38}}{2×1{0}^{-13}}}$mol/L=3×10-6mol/L,
故答案为:3×10-6.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断、难溶物的溶解平衡等知识点,侧重考查学生分析判断及计算能力,明确基本原理、物质性质是解本题关键,难点是(4)的计算,注意:HCO3-对应的酸根离子是CO32-,为易错点.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

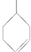 .
.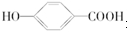 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.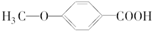 的同分异构体很多,其中符合下列条件的有3种.
的同分异构体很多,其中符合下列条件的有3种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的最高价氧化为对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z与X的最高价氧化物对应水化物反应可产生W的单质气体 | |
| B. | X、Y、Z三种元素的最高价氧化物对应水化物两两可发生反应 | |
| C. | Y的氧化物都可做呼吸面具的供氧剂 | |
| D. | W与X之间只能形成极性共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 漂白粉溶液中通入适量的SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com