
| A. | Na2O2 | B. | CaCL2 | C. | 氮气 | D. | CCL4 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| D. | 结构简式为 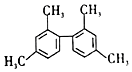 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中可能含有SiO32- | |
| B. | 生成的气体中一定有NO,可能含有CO2 | |
| C. | 溶液中减少的离子是SO32-、I-、NO3- | |
| D. | 原溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| B. | 铝容易形成致密的氧化膜,抗腐蚀性能好 | |
| C. | 工业上电解氯化铝溶液可分解得到铝和氯气 | |
| D. | 工业上常用铝热反应进行焊接铁轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
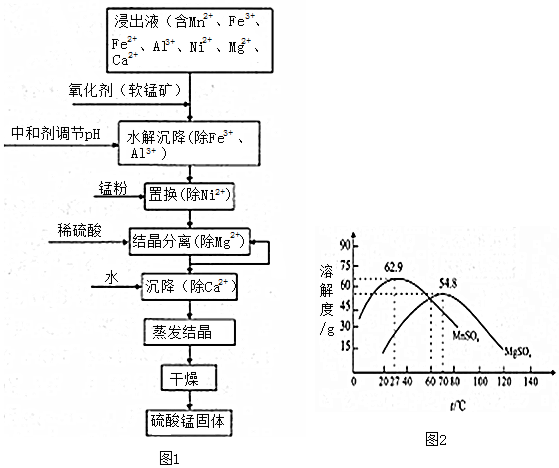
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com