
分析 滴定时发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据方程式计算HCl的物质的量,再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度,根据稀释定律计算稀释后盐酸的物质的量浓度,根据体积之比计算消耗HCl的物质的量,由方程式NaOH+HCl=NaCl+H2O计算NaOH的物质的量,再根据m=nM计算NaOH的质量,进而计算其质量分数.
解答 解:0.53g碳酸钠的物质的量为$\frac{0.53g}{106g/mol}$=0.05mol,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
0.05mol 0.1mol
故盐酸的浓度为$\frac{0.1mol}{0.1L}$=1mol/L
由稀释定律,稀释后盐酸的浓度为$\frac{1mol/L×20mL}{200mL}$=0.1mol/L
滴定样品时,稀盐酸和烧碱溶液的体积比为3:2,则消耗HCl为0.1mol/L×$\frac{3}{2}$×1L=0.15mol,
NaOH+HCl=NaCl+H2O
0.15ol 0.15mol
故样品中NaOH的质量为0.15mol×40g/mol=6g
样品中烧碱的纯度为$\frac{6g}{6.25g}$×100%=96%
答:工业烧碱的纯度为96%.
点评 本题考查滴定的应用、物质含量的测定,旨在考查学生化学方程式有关计算,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | Cu是原电池的负极 | |
| B. | Al是原电池的负极 | |
| C. | 电子由Al沿导线流向铜 | |
| D. | 铝片上的电极反应式为:Al-3e-═AL3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


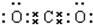


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4与18 g NH4+所含质子数相等 | |
| B. | 0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L | |
| D. | 7.8 g Na2O2中含有的离子总数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com