
| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
分析 A.混乱度越大,熵值越大;
B.由反应可知,△H>0、△S>0,能自发进行,可知△H-T△S<0;
C.利用综合判据△H-T△S与0的关系;
D.使用催化剂,只能改变反应速率,与反应的方向无关.
解答 解:A.混乱度越大,熵值越大,则同一物质的固、液、气三种状态的熵值由s→g增大,故A错误;
B.由反应可知,△H>0、△S>0,能自发进行,可知△H-T△S<0,可知体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C.利用综合判据△H-T△S与0的关系,△H-T△S<0能自发进行,不能单独使用焓变、熵变判断反应进行的方向,故C错误;
D.使用催化剂,只能改变反应速率,与反应的方向无关,不能改变化学反应进行的方向,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握焓变、熵变的判断及反应进行方向的综合判据为解答的关键,侧重分析与应用能力的考查,注意不能单独使用焓变、熵变判断反应进行的方向,题目难度不大.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 变为原来的10-3倍 | B. | 变为 原来的10-2倍 | ||
| C. | 变为原来的103倍 | D. | 不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通常用小黑点来表示电子的多少 | |
| B. | 小黑点密表示在该核外空间的电子数多 | |
| C. | 小黑点密表示在该核外空间的单位体积内电子出现的概率大 | |
| D. | 通常用小黑点来表示电子绕核作高速圆周运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废弃物切成碎片,混在垃圾中填埋于土壤中 | |
| B. | 将废弃物焚烧 | |
| C. | 将废弃物加工成防水涂料或汽油,以节约资源 | |
| D. | 将废弃物倾倒在海洋中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO 完全燃烧,放出热量为 283 J | |
| B. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1 | |
| C. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 1.204×1024 | |
| D. | CO 的燃烧热为 566 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol•L-1 | B. | 0.1 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
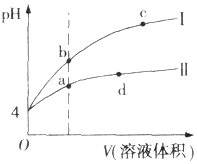 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com