
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,Y和Z两元素的原子序数之和等于W元素的原子序数。下列说法错误的是( )

A.X、Y、W分别与Z都能形成两种或两种以上的化合物,这些化合物都能与NaOH反应
B.X、Y、Z都能形成10、18 电子的氢化物分子,其中X的最简单氢化物沸点最低
C.Y、Z、W与氢四种元素能组成离子化合物,该化合物能发生水解
D.最高价氧化物对应水化物的酸性:Y>W>X
【答案】A
【解析】
根据短周期元素的相对位置,假设Y原子序数为a,则Z为a+1,W为a+8,由于Y和Z两元素的原子序数之和等于W元素的原子序数,所以a+(a+1)=a+8,解得a=7,所以X是C元素,Y是N元素,Z是O元素,W是P元素,然后结合元素的性质与元素的原子结构分析解答。
根据上述分析可知:X是C元素,Y是N元素,Z是O元素,W是P元素。
A.C、O元素形成的化合物CO、N、O元素形成的化合物NO都不能与NaOH溶液反应,A错误;
B.C与H形成CH4、C2H6,N与H可形成NH3、N2H4、Z与H形成H2O、H2O2,含有的电子数分别是10、18,在这些物质中X的最简单氢化物CH4相对分子质量最小,只存在分子间作用力,无氢键存在,因此其沸点最低,B正确;
C.Y、Z、W与氢四种元素能组成离子化合物(NH4)3PO4等物质,该化合物是弱酸弱碱盐,在溶液中NH4+、PO43-都会发生水解反应,使水电离程度增大,C正确;
D.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性N>P>C,所以最高价含氧酸的酸性:HNO3>H3PO4>H2CO3,D正确;
故合理选项是A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )

A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛是一种珍贵香料,广泛应用于香料、医药、染料及农药行业。其合成路线如图所示(部分反应产物和反应条件已略去):

已知有机化学反应条件不同,可生成不同的产物:
HX+CH3-CH=CH2 (X为卤素原子)
(X为卤素原子)
回答下列问题:
(1)①的反应类型为___;D中的含氧官能团名称是___。
(2)反应④的化学方程式为___。反应⑤的试剂是___,反应条件是___。
(3)已知A为混合物,设计步骤③、④的目的是___。
(4)龙葵醛与新制Cu(OH)2反应并酸化后得到E,符合下列两个条件的E的同分异构体共有___种。①能发生银镜反应,也能发生水解反应;②是苯环的二元取代产物。写出其中核磁共振氢谱有5种吸收峰的物质的结构简式:___。
(5)参照上述合成路线,设计以2甲基1,3丁二烯为原料,经三步制备2甲基1,4丁二醛( )的路线。__
)的路线。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫废水的主要超标项目为悬浮物、重金属阳离子(Hg2+、Cu2+等)、SO42-。某工厂采用如下流程进行脱硫废水处理。其中助凝剂为聚丙烯酰胺![]()
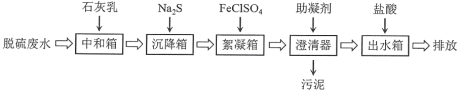
下列说法不正确的是
A.该方案用石灰乳仅用来调节pH使大部分重金属阳离子形成氢氧化物沉淀
B.加入Na2S可以将进入沉降箱的Hg2+,Cu2+转化为硫化物沉淀
C.加入FeClSO4是利用Fe3+易水解的性质,形成胶体吸附悬浮物
D.助凝剂聚丙烯酰胺是加成聚合反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对于可逆反应A(g)+3B(g) ![]() 4C(g)的叙述中,能说明反应已达到平衡的是( )
4C(g)的叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗4a mol的C同时分解a mol AB.混合气体的物质的量不再变化
C.单位时间内消耗3a mol B同时生成4a mol CD.容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com