
【题目】(1)如图所示的装置在实验室中用途比较广泛:

①排空气法收集气体,若收集CO2气体,进气口为_______ (填“a”或“b”)。
②若瓶中装满水,可用于收集下列气体中的_________(选填编号)。
A、NO B、NO2 C、NH3 D、HCl
此时进气口为____________(填“a”或“b”)。
③如果广口瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体有____________(选填编号)。
A、HCl B、NH3 C、H2 D、CO
④此装置还可用于除去气体中的杂质气体。若要用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是____________(选填编号)。
A、NaOH溶液 B、饱和Na2CO3溶液 C、饱和NaHCO3溶液 D、浓H2SO4
(2)下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是_____________(填选项)
②可用作反应容器并能进行加热的是___________(填选项)
③下列操作,使得实验结果偏小的是____________(填选项)
A.称取5.2 gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C. 配制一定物质的量浓度的NaCl溶液,定容时俯视读数。
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯。
【答案】 a A b B C AB CD A
【解析】(1)①二氧化碳密度大于空气,应该采用向上排空气法收集二氧化碳,采用“长进短出”的原则,则a为进气口;
②不易溶于水的气体可以采用排水法收集,二氧化氮、氨气和氯化氢都能和水反应,所以不能用排水法收集,只有NO不易溶于水,所以NO采用排水法收集,为将水排除,则气体进气口为b;
③浓硫酸具有酸性和强氧化性,不能干燥部分有还原性的气体、不能干燥碱性气体,氨气属于碱性气体,所以不能干燥氨气,故答案为B;
④NaOH溶液、饱和Na2CO3溶液与二氧化碳、二氧化硫都反应,浓H2SO4和二氧化硫、二氧化碳都不反应,所以不能除杂,二氧化硫和水反应生成亚硫酸,亚硫酸的酸性大于碳酸,所以亚硫酸和NaHCO3溶液反应生成二氧化碳,且二氧化碳和碳酸氢钠不反应,所以可以除去二氧化碳中的二氧化硫,故答案为C;
(2)①液体的体积受温度的影响,温度不同时,用量筒量取的液体、容量瓶的液体的体积不同,导致产生误差,故答案为AB;
②可作反应容器并可加热的是试管和圆底烧瓶,量筒、容量瓶、托盘天平不能用来加热,故答案为CD;
③称量时左物右码,颠倒后称取质量减小,浓度偏小;最后需要定容,容量瓶中已有少许蒸馏水,无影响,故答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
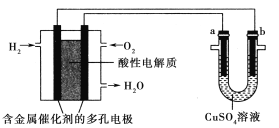
A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.电解精炼铜时,若转移1mol电子,a极质量减少32g
C.铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.直径介于1nm~100nm之间的微粒称为胶体
B.电泳现象可证明胶体带电
C.渗析法可用于含有氯化钠的淀粉溶液的提纯
D.用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
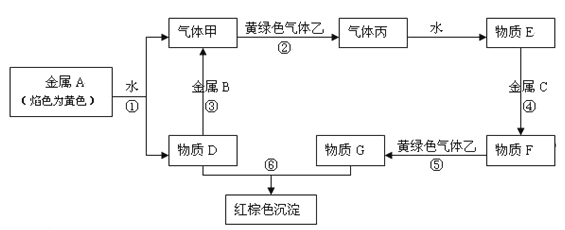
请根据以上信息回答下列问题:
(1)写出金属元素A的原子结构示意图:_______________。
(2)写出下列反应的离子方程式:
反应③___________;反应⑤____________________
(3)检验物质G中阳离子的操作方法_____________________。
(4)实验室制取黄绿色气体乙的化学方程式为__________________,在该反应中如有0.5 mol乙生成,转移的电子的物质的量是_____mol。制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
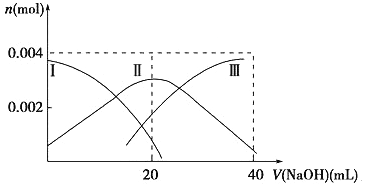
当V(NaOH)=20 mL时,溶液中离子浓度大小关系:____________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水____________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=____________。
Ⅱ.已知:在25 ℃时 H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH![]() H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh具体数值=________________,
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a,1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为___________, a与b的关系为______________。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列金属的熔沸点:
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
不能形成合金的两金属是( )
A.Cu与Na
B.Fe与Cu
C.Fe与Al
D.Al与Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com