
| A.0.4 mol | B.0.2 mol | C.0.15 mol | D.0.075 mol |
科目:高中化学 来源:不详 题型:填空题
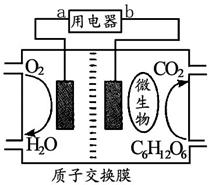
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性锌锰电池是二次电池 |
| B.正极反应为:2 MnO2+2H2O+2e-=2MnOOH+2OH- |
| C.连续工作后的碱性锌锰电池中电解液的pH将减小 |
| D.工作中,每转移0.2mole-时,负极质量减轻6.5g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在烧杯①中,若构成微型电池,负极反应式为2H2O十2e-═2OH-+H2↑ |
| B.在烧杯②中,若铁、铜构成微型电池,则铜为负极 |
| C.在烧杯①中,若构成微型电池,铝为负极 |
| D.在烧杯②中,向溶液中滴加KSCN溶液,溶液一定变为红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2 + 4e-→Ti + 2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极反应式为:O2+2H2O+4e=4OH- |
| B.负极反应式为:CH4+10OH--8e=CO32-+7H2O |
| C.随着放电的进行,溶液的pH不变 |
| D.放电时溶液中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.锌筒作负极,发生氧化反应 |
| B.电子从锌流向碳棒,碳棒得电子被还原 |
| C.电池内部的NH4+ 向碳棒移动 |
| D.将NH4Cl更换为KOH能提高电池寿命和性能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通H2的一极是正极,通O2的一极是负极? |
| B.通O2的一极是正极,通H2的一极是负极 |
| C.工作一段时间后电解质溶液pH增大? |
| D.工作时正极区附近pH减小? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH| A.放电时每转移6mol电子,负极有2mol K2FeO4被还原 |
| B.充电时阴极反应为:Zn(OH)2 + 2e— = Zn+ 2OH— |
C.放电时正极反应为:FeO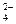 + 3e— + 4H2O = Fe(OH)3 + 5OH— + 3e— + 4H2O = Fe(OH)3 + 5OH— |
| D.充电时Zn电极与外电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com