
����Ŀ��50 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
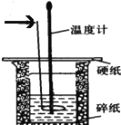
��1����ͷ��ָ����������Ϊ______________________________��
��2����ͼ��ʾʵ��װ�ô�����һ�������������_______________��
��3����ijͬѧʵ���и���60 mL 0.50 mol��L��1ϡ�����50 mL 0.55 mol��L��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_______(���ȡ�����ȡ�)�������к���_______________(���ȡ�����ȡ�)��
��4����ijͬѧ�ø������װ����ʵ�飬��ɲ���к��ȵ���ֵƫ�ͣ�����������ܵ�ԭ����________��
A������ʵ��ĵ������½ϵ�
B������ȡ����ʱ���ӿ̶���
C������ȡ����������Һʱ���ӿ̶���
D����50mL0.55mol/L����������Һȡ����50mL0.55mol/L�İ�ˮ
E������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ���ȥ��������������Һ���¶�
F������Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ�
���𰸡� ���β�������� ���ձ���С�ձ�δ��ƽ ����� ��� ABCDEF
��������������������⿼���к��ȵIJⶨ����������
��1����ͷ��ָ����������Ϊ���β����������
��2�����к��Ȳⶨʵ����Ҫ����������ɢʧ��ͼ��ʵ��װ�õĴ����ǣ����ձ���С�ձ�δ��ƽ��
��3����ijͬѧʵ���и���60mL0.50mol/Lϡ������50mL0.55mol/LNaOH��Һ���з�Ӧ����������H2O���ʵ�������������ų�����������ȡ���Ϊϡ�����NaOH��Һ�ķ�Ӧ��ϡ�����NaOH��Һ�ķ�Ӧ������д��H++OH-=H2O���к���������1molH2O�����������������أ����������к�����ȡ�
��4��A���ʵ��ĵ������½ϵͣ��²������ɢʧ�϶࣬����к�����ֵƫ�ͣ�B�����ȡ����ʱ���ӿ̶��ߣ������������ƫС��n��HCl��ƫС����Ӧ�ų�������ƫ�ͣ�����к�����ֵƫ�ͣ�C�����ȡNaOH��Һʱ���ӿ̶��ߣ�����NaOH��Һƫ����Һ������ƫ�����NaOH������������Ӧ���¶�����ֵƫС������к�����ֵƫ�ͣ�D�����50mL0.55mol/L��ˮ����50mL0.55mol/LNaOH��Һ�����ڰ�ˮΪ����ˮ��Һ������ĵ��������ȹ��̣�����к�����ֵƫ�ͣ�E�����������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ���ȥ����NaOH��Һ���¶ȣ���ʱ�������¶ȼ��ϵ�������NaOH��Ӧ�������ɢʧ������к�����ֵƫ�ͣ�F�����Ͳ�е�NaOH��Һ����С�ձ�ʱ�����ٻ�������ɢʧ�϶࣬����к�����ֵƫ�ͣ�����ɲ�õ��к�����ֵƫ�͵���ABCDEF��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽ����Ҫ����ǣ� ��
A.��������ƽ��ȡ35.20g NaCl
B.��10ml��Ͳ��ȡ8.50ml����
C.��25ml�ζ�����ȡ15.80ml��Һ
D.�ù㷺PH��ֽ�����ҺPHֵΪ4.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������̼�����ʣ�����ûʳ������Һ������������������������˵����ȷ���ǣ�������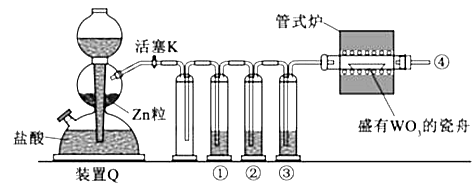
A.�١��ڡ���������ʢװKMNO4��Һ��ŨH2SO4������ûʳ������Һ
B.��ʽ¯����ǰ�����Թ��ڢܴ��ռ����岢��ȼ��ͨ�������ж�����Ũ��
C.������Ӧʱ���ȹرջ���K����ֹͣ����
D.װ��Q�����շ�������Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù���������������һ�����ʵ���Ũ����Һʱ�����в����ܵ�����ҺŨ��ƫ�ߵ��ǣ� ��
A.���ձ����ܽ�ʱ��������Һ�彦��B.��Ʒ�л���̼���ƹ���
C.����ƿʹ��ǰδ������D.����ʱ��������ƿ�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽����������ϡ����������Һ�ķ�Ӧ��ʵ�������װ��A���ձ��ڵ���Һ�¶����ߣ�װ��B���ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣

��1��װ��A�ձ��з�Ӧ�����ӷ���ʽΪ_________��
��2��װ��B��Mg�ϵ�������_________��Al�����ĵ缫��Ӧʽ��__________________��
��3����װ��B������ͨ��0.3mol����ʱ��װ��B�ձ�����Һ�������仯Ϊ__________�������ػ������ٿˣ���
��4����С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________������ĸ��ţ���
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B��ԭ���װ����Ҫ2���缫
C���缫һ�����ܲμӷ�Ӧ
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
E��ԭ��ص�����������������Ļ���йأ�����Ҳ��������Һ�й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molW�����0.5molX��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4W(g)+3X(g) ![]() 2Y(g)+nZ(g)��2minĩ������0.2mol Y������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0025mol/(L��s)���Լ���
2Y(g)+nZ(g)��2minĩ������0.2mol Y������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0025mol/(L��s)���Լ���
��1��ǰ2min����W��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ_______________��
��2��2minĩʱX��Ũ��Ϊ_____________________________��
��3����ѧ��Ӧ����ʽ��n=_____________________________��
��4��2minĩ���ָ�����Ӧǰ�¶ȣ���ϵ��ѹǿ�Ƿ�Ӧǰѹǿ��__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��CaC2O4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ� �� 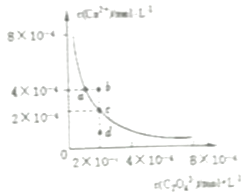
A.��CaC2O4������Һ�м������Na2C2O4������a��䵽b��
B.ͨ������������d��䵽c��
C.d����CaC2O4��������
D.a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3ClΪ��ɫ���Դ���ζ�����壬�ܶ�Ϊ2.25g/L���۵�Ϊ��24.2�棬��������ˮ���������Ҵ��ͱ������л��ܼ��� ��ʵ������ȡCH3Cl��ԭ����CH3OH+HCl��Ũ�� ![]() CH3Cl+H2O�����岽�����£�
CH3Cl+H2O�����岽�����£�
�ٸ���ZnCl2���壻
�ڳ�ȡ24g��ϸ����ˮZnCl2����ȡ20mLŨ�������Բ����ƿ��ͬʱ��ȡһ�����ļ״������Һ©���У�
�۽���Һ©����ļ״���ε�����ƿ�в����ȣ���ZnCl2��ȫ�ܽ����CH3Cl�����ݳ���������ˮ���ռ���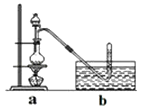
��ش�
��1��ʵ���Ҹ���ZnCl2�����Ƶ���ˮZnCl2�ķ�����
��2����Ӧ�����е�����ƿ�м״�������������٣��״���Ũ��������ʵ���Ũ�Ƚӽ����������� ��
��3��ʵ����Ϊ������ˮ���ռ�CH3Cl��
��4����ij���ϼ��أ�CH4�����е�һ��Hԭ�ӱ�Clԭ��ȡ�������ȶ����ܵ�Ӱ�죬�ɱ�ǿ���������Ը������������������ֻϴ��ƿ���ֱ�ʢ�������Լ��� A.1.5%KMnO4��H+����Һ�� B������ˮ��C.5%Na2SO3��Һ�� D.98%H2SO4
Ϊ֤ʵ��һ���۵Ŀɿ��ԣ��������ѡ����ǡ����ϴ��ƿ����aװ�����ɵ���������ͨ��ϴ��ƿ����ϴ��ƿ��ţ�������۲쵽��֤ʵ�������ϵ���ȷ�ԣ�
��5��д��ϴ��ƿ�з�����Ӧ�����ӷ���ʽ��CԪ�ص���������ΪCO2����
��6�����CH3Cl�Ǵ�������Ⱦ�����ϴ��ƿ֮��Ӧ��һֻʢ��ϴ��ƿ��
��7��ijС��ͬѧȡVmL��CH3Cl��Ⱦ��ˮ������ƿ�У���0.10molL��1����KMnO4��Һ���еζ���ʵ���������������ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.02 | 20.00 | 19.98 |
��һ��ʵ�����ݳ����쳣����������쳣��ԭ�������������ĸ���ţ���
a����ƿϴ����δ���� b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ�����������ƿʱ��Һ�彦�� d���ζ��յ�ʱ���Ӷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LED��Ʒ��ʹ��Ϊ��������ɫ�ʡ���ͼ������ȼ�ϵ������LED�����һ��װ��ʾ��ͼ�������й�������ȷ���ǣ� ��
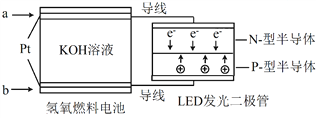
A. ��·�еĵ��ӴӸ��������·���������پ���KOH��Һ�ص��������γɱպϻ�·
B. a��ͨ�������� b��ͨ��������װ�ý���ѧ������ת��Ϊ����
C. ��طŵ�� OH�������ʵ���Ũ�ȼ�С
D. ͨ��O2�ĵ缫������Ӧ��O2 + 4e�� �� 2O2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com