
| A. | 0.lmol/LCH3COONa溶液:c(Na+)═c(CH3COO-) | |
| B. | 0.1mol/LNa2CO3溶液:c(Na+)═c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向醋酸钠溶液加适量醋酸所得溶液:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+) |
分析 A.0.lmol/LCH3COONa溶液中醋酸根离子水解;
B.0.1mol/LNa2CO3溶液中存在物料守恒,n(Na)=2n(C);
C.向醋酸钠溶液加适量醋酸所得溶液,溶液中存在电荷守恒;
D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合,一水合氨又电离出氢氧根离子,溶液显碱性;
解答 解:A.0.lmol/LCH3COONa溶液中醋酸根离子水解,c(Na+)>c(CH3COO-),故A错误;
B.0.1mol/LNa2CO3溶液中存在物料守恒,n(Na)=2n(C),c(Na+)═2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.向醋酸钠溶液加适量醋酸所得溶液,溶液中存在电荷守恒,阴阳离子所带电荷总数相同,c(Na+)+c(H+)═c(CH3COO-)+c(OH-),故C正确;
D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合,一水合氨又电离出氢氧根离子,溶液显碱性,c(Cl-)<c(NH4+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,电解质溶液中物料守恒、弱电解质电离平衡、盐类水解原理等知识点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 | |
| D. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸根离子的化学式:ClO- | B. | 干冰的分子式:H2O | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Na+、CO32-、Cu2+、Cl- | ||
| C. | K+、Na+、Cl-、NH4+ | D. | K+、Cl-、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性由高到低:NH3>PH3 | B. | 晶体熔点由高到低:SiC14>SiO2 | ||
| C. | 酸性由强到弱:HC1O4>HC1O | D. | 晶体熔点由高到低:MgO>MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
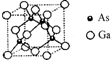 砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.
砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 某反应的平衡常数K300℃>K350℃,则该反应△H<0 | |
| D. | 合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com