
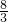 mol硝酸,1molCu2O消耗
mol硝酸,1molCu2O消耗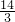 mol硝酸,1molCuO消耗2mol硝酸,
mol硝酸,1molCuO消耗2mol硝酸, =0.025mol,
=0.025mol, =0.005mol
=0.005mol =0.015 mol
=0.015 mol =0.01mol
=0.01mol

 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:阅读理解
| 10 |
| 9 |
| 10 |
| 9 |

查看答案和解析>>
科目:高中化学 来源: 题型:
Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的离子方程式________。
(2)产物中硝酸铜的物质的量 。
(3)如混合物中含0.01 mol Cu,则含Cu2O mol、含CuO____mol。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省萧山中学高三10月份月考化学试卷 题型:填空题
Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的离子方程式________。
(2)产物中硝酸铜的物质的量 。
(3)如混合物中含0.01 mol Cu,则含Cu2O mol、含CuO____mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的离子方程式________。
(2)产物中硝酸铜的物质的量 。
(3)如混合物中含0.01 mol Cu,则含Cu2O mol、含CuO____mol。
查看答案和解析>>
科目:高中化学 来源:2011年天津二十中高考化学三模试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com