
| A. | Fe+2HCl═H2↑+FeCl2 | B. | 2FeCl2+Cl2 ═2FeCl3 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2Fe(OH)3 $\frac{\underline{\;△\;}}{\;}$Fe2O3+3H2O |
分析 氧化还原反应的特征是元素化合价的升降,如有元素化合价的变化,则属于氧化还原反应,结合分解反应和化合反应、置换反应的特点解答该题.
解答 解:A.Fe+2HCl═H2↑+FeCl2属于置换反应,故A错误;
B.2FeCl2+Cl2 ═2FeCl3为化合反应,铁和氯元素化合价发生变化,属于氧化还原反应,故B正确;
C.CaO+H2O═Ca(OH)2没有化合价的变化,不属于氧化还原反应,故C错误;
D.2Fe(OH)3 $\frac{\underline{\;△\;}}{\;}$Fe2O3+3H2O属于分解反应,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,把握物质的反应类型的判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Y2+ | B. | X2+ | C. | Z2+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Na+,Br-,Fe3+ | B. | H+,K+,MnO${\;}_{{4}^{\;}}$-,C2O42- | ||
| C. | K+,H+,NO3-,I- | D. | Na+,H+,SO32-,S2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气的实验室制法
氯气的实验室制法查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 空石英管质量 m0/g | 石英管与钙的质量 m1/g | 石英管与产物的质量 m2/g |
| 14.800 | 15.080 | 15.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
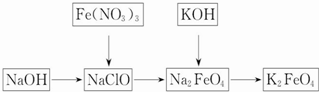
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
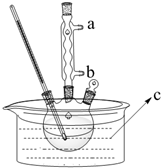 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com