
(1)电解过程中溶液颜色变浅而水量不变____________________。
(2)电解过程中电解质含量不变,水量减少____________________。
(3)电解过程中溶液的pH减小_______________________________。
(4)电解过程中,两极析出气体的体积比为1∶1________________。
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OH- NO3- I- HCO3- AlO2- HSO4- |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 错误观点 | 离子方程式 | |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-=H2O |
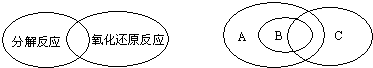
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| B |
| A |
| B |
| A |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H | He | ||||||
| 1.3120 | 0.3723 | ||||||
| Li | Be | B | C | N | O | F | Ne |
| 0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
| Na | Mg | Al | Si | P | S | Cl | Ar |
| 0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
| K | Ca | Ga | Ge | As | Se | Br | Kr |
| 0.4189 | 0.5898 | 0.5788 | x | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
| Rb | Sr | In | Sn | Sb | Te | I | Xe |
| 0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
| Cs | Ba | Tl | Pb | Bi | Po | At | |
 主族元素
主族元素 )最近的C(用 表示)的位置.
)最近的C(用 表示)的位置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com