
下列说法正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,
则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75 ,该溶液中c(A2-)< c(H2A)
C.室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol·L-1时,
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol·L-1时,
溶液的pH等于14+ 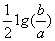
D.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO )>c(NH
)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
甲醇脱水反应
2CH3OHg)===CH3OCH3g)+H2Og)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OHg)===C2H4g)+2H2Og)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OHg)===CH3OCH3g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4g)+H2Og)===C2H5OHg)的ΔH=________kJ·mol-1。
2)[2012·广东理综,314)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Lis)+I2s)===2Lis) ΔH
已知:4Lis)+O2g)===2Li2Os) ΔH1
4LiIs)+O2g)===2I2s)+2Li2Os) ΔH2
则电池反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A池用石墨电极电解pH=13氢氧化钠溶液(100 mL),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24 L,则下列说法正确的是(双选)( )。

A.d电极质量一定减少6.4 g
B.c电极质量一定增加6.4 g
C.A池pH增大
D.A池溶液质量减少3.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构
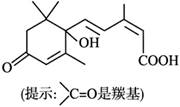 如图,下列关于该物质说法正确的是
如图,下列关于该物质说法正确的是
A. S-诱抗素制剂能发生酯化反应的官能团有2种
B. 含有苯环、羟基、羰基、羧基、碳碳双键
C. 1 mol S-诱抗素制剂与足量金属Na反应生成0.5 mol H2
D. 该化合物不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
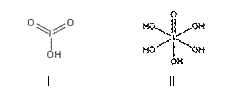 (4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
 (6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子
以4配位数交替配位形成层结构
 B.用均摊法可知平均每个晶胞中有4个碘原子
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
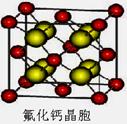
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏
加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的
相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(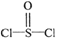 )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响。
B.金属锂作电池的正极,石墨作电池的负极。
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3。
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:l。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用赤铁矿生产铁,可以选择的还原剂有C和H2。根据所学的知识判断:哪一种还原剂可使反应自发进行的温度较低?
已知:Fe2O3(s)+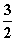 C(s)===2Fe(s)+
C(s)===2Fe(s)+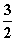 CO2(g)
CO2(g)
ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1
Fe2O3(s)+3H2(g)===2Fe(s)+3H2O(g)
ΔH=98 kJ·mol-1,ΔS=0.144 2 kJ·mol-1·K-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①Fe(s)+CO2(g)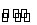 FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)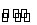 FeO(s)+H
FeO(s)+H 2(g)的平衡常数为K2。 反应CO2(g)+H2(g)
2(g)的平衡常数为K2。 反应CO2(g)+H2(g) 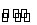 CO(g)+H2O(g)的平衡常数K为( )
CO(g)+H2O(g)的平衡常数K为( )
A.K1+K2 B.K1-K2 C.K1· K2 D.K1/K2
K2 D.K1/K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com