
| A. | ①④⑥⑧ | B. | ②④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③⑥⑦⑧ |
分析 弱电解质在溶液中不完全电离的电解质,可以根据醋酸的电离程度及醋酸钠溶液的酸碱性判断醋酸的强弱.
解答 解:①醋酸与水以任意比例互溶,说明醋酸的溶解度大,而不能证明醋酸的电离程度,所以不能证明醋酸为弱酸,故错误;
②醋酸溶液能导电,说明醋酸在水溶液里能电离出阴阳离子,为电解质,而不能证明醋酸的电离程度,所以不能证明醋酸为弱酸,故错误;
③醋酸溶液中存在醋酸分子,说明醋酸部分电离,即能证明醋酸为弱电解质,故正确;
④测得醋酸的pH比盐酸pH大,但是不知道二者的浓度,所以不能确定醋酸是否完全电离,则不能证明醋酸为弱酸,故错误;
⑤在漂白剂溶液中滴加醋酸能增强漂白效果,说明醋酸能电离出氢离子,但是不能确定醋酸是否完全电离,则不能证明醋酸为弱酸,故错误;
⑥0.1mol/L醋酸溶液的pH=2,说明醋酸部分电离,即能证明醋酸为弱电解质,故正确;
⑦CH3COOK溶液能使酚酞试液变红色,说明醋酸根离子发生水解溶液显碱性,即醋酸为弱酸,即能证明醋酸为弱电解质,故正确;
⑧大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢,说明醋酸中氢离子浓度小,即醋酸不完全电离,能证明醋酸为弱电解质,故正确;
故选D.
点评 本题考查了强弱电解质的判断,根据电解质的电离程度确定电解质的强弱,可以从醋酸溶液中醋酸浓度与pH的相对大小、醋酸钠溶液的酸碱性来确定,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 二氧化氯、臭氧均可用作自来水消毒剂 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 化妆品中的甘油可起到保湿滋润皮肤的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应,起始时二者产生氢气的速率基本相等 | |
| B. | 100mL 1mol/L的盐酸和50mL 2mol/L的盐酸分别与足量的锌反应,二者放出氢气的速率和质量均相等 | |
| C. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等 | |
| D. | 100mL 0.1mol/L的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量与后者相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Vl=V2,且混合溶液pH<7,则必有c1<c2 | |
| B. | 若混合溶液的pH=7,则混合溶液中c(Na+)=c (CH3COO-)+c(CH3COOH ) | |
| C. | 若混合溶液的pH>7,则混合溶液中c(Na+)<c( CH3COO-) | |
| D. | 若Vl=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
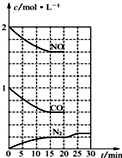 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com