
科目:高中化学 来源: 题型:阅读理解
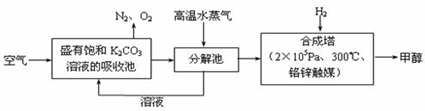
查看答案和解析>>
科目:高中化学 来源:2010年福建省福州市八县(市)协作校第一学期期中联考高二理科化学试卷 题型:选择题
酸性高锰酸钾溶液与草酸溶液反应的化学方程式为2 KMnO4 + 3 H2SO4 + 5 H2C2O4 = K2SO4 + 2 MnSO4 + 10 CO2↑+ 8 H2O ,下列措施不能使反应速率加快的是( )
A.增大酸性高锰酸钾溶液的浓度 B.增大草酸溶液的浓度
C.增大压强 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH(g)。
CH3OH(g)。

(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(4)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
科目:高中化学 来源:2010年上海市宝山、静安、杨浦、青浦四区高考模拟考试 题型:填空题
工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g) CH3OH
(g)。
CH3OH
(g)。

(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(4)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com