
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
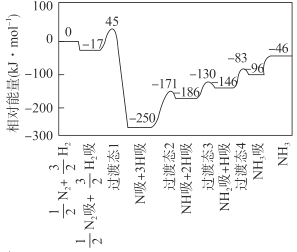
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是
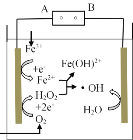
A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
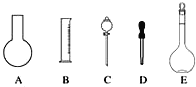
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为______g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“偏高”、“偏低”或“不变”);
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“偏高”、“偏低”或“不变”)。
(3)在配制硫酸溶液时:
①需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积_______ml;
②在配制硫酸溶液时需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求:
①被氧化前钠块的质量__________________。
②所得溶液中溶质的质量分数_____________(计算结果均保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是含有碳、氢、氧三种元素的有机物,其中A、C分别是白酒和食醋中含有的成分,A、B、C、D间有如下转化关系:
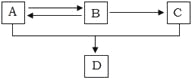
请回答下列问题:
(1)B物质中官能团为_____。
(2)写出A与C在浓H2SO4存在条件下加热反应生成D的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用氧化剂+浓盐酸![]() 金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为____mol。
(2)反应后溶液中HCl的物质的量浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
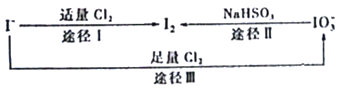
A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质及其化合物是常见的物质。完成下列填空:
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)→CO2(g)+393.51kJ;C(金刚石)+O2(g)→CO2(g)+395.41kJ
(1)等质量时石墨的能量比金刚石的___(选填“高”或“低”),由石墨制备金刚石是___反应(选填“吸热”或“放热”)。
由焦炭与石英在高温的氮气流中反应,可制得一种新型陶瓷材料——氮化硅(Si3N4):C+SiO2+N2→Si3N4+CO(未配平)
(2)配平后的化学方程式各物质的化学计量数依次是___。若已知CO生成速率为v(CO)=12mol/(L·min),则N2消耗速率为v(N2)=___mol/(L·min)。
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:K=![]() 。
。
(3)该反应的化学方程式为___。
(4)能判断该反应一定达到平衡状态的是___。
a.v正(H2O)=v逆(CO)
b.容器中气体的相对分子质量不随时间改变
c.消耗nmolH2同时消耗nmolCO
d.容器中物质的总物质的量不随时间改变
(5)已知常温下0.1mol/L碳酸氢钠溶液的pH=8.4,该溶液中的c(H2CO3)___c(CO32-)(选填“>”、“=”或“<”);该溶液电中性的表达式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com