
| A.SO2和Si | B.CO2和H2O |
| C.NaCl和HCl | D.CCl4和KCl |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
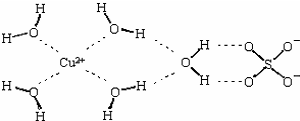
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔融态不导电 | B.水溶液呈中性 |
| C.熔点比BeBr2高 | D.不与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点是1070℃,易溶于水,水溶液能导电 |
| B.熔点是10.31℃,液态不导电,水溶液能导电 |
| C.能溶于水,熔点812.8℃,沸点是1446℃ |
| D.熔点是97.80℃,质软、导电,密度是0.97g/cm3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.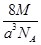 g·cm-3 g·cm-3 | B.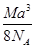 g·cm-3 g·cm-3 |
C.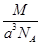 g·cm-3 g·cm-3 | D.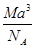 g·cm-3 g·cm-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com