
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g) ⇋ 1/4CaS(s)+CO2(g) ∆H1 = -47.3kJ∙mol-1
② CaSO4(s)+CO(g) ⇋ CaO(s)+CO2(g) +SO2(g) ∆H2 = +210.5kJ∙mol-1
③ CO(g) ⇋ 1/2C(s)+1/2CO2(g) ∆H3 = -86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g) ⇋ CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)

 的∆H=__________(用∆H1、∆H2和∆H3表示)
的∆H=__________(用∆H1、∆H2和∆H3表示)
|
 | |||
| |||
|
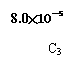 | |||
 | |||
图19
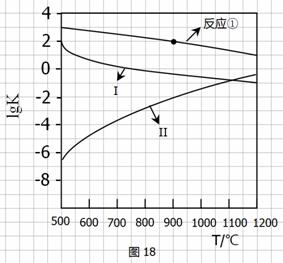
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,回答下列问题。a)曲线中对应反应②的是_______(选填“Ⅰ”或“Ⅱ”)。
归纳lgK-T曲线变化规律: b)_________ ________ 。
c)_____ ___ 。
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol∙L-1 的CO,反应①于900℃
达到平衡,此时c平衡(CO)=8.0X10-5 mol∙L-1。
d)用图18中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字)。
e) c(CO)随反应时间t的变化曲线如图19所示。
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应)。
(1)4∆H1+∆H2+2∆H3(2分)
(2)a)Ⅱ(2分)
b)当∆H>0时,lgK随温度升高而增大(1分),当∆H<0时,lgK随温度升高而减小(1分)。其他合理答案也给分
得分点:放热(吸热)反应的lgK随温度变化的关系正确就得1+1=2分。
c) 当温度同等变化时,∆H的数值越大lgK的变化越大或∆H的数值越大lgK受温度的影响越大或放热越多,lgK受温度的影响越大(2分)。其他合理答案也给分
得分点:∆H的数值大小与lgK随温度变化的关系正确就得2分。
| (3)d)(4分)解: 1/4CaSO4(s)+CO(g) ⇋ 1/4CaS(s)+CO2(g) 初始浓度(mol/L) C0 0 转化浓度(mol/L) C0 — 8.0X10-5 C0 — 8.0X10-5 平衡浓度(mol/L) 8.0X10-5 C0 — 8.0X10-5 (1分) K= c( CO2 )/ (c(CO)=100(1分),解得: C0=808 X 10-5(1分) 所以α(CO)=99%(1分) | (3)e) (4分) 每个图1+1=2分(影响速率1分,影响平衡1分)
|


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+ 2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH 3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示) 。
⑵分析二 甲醚合成反应④对于CO转化率的影响 。
甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。

⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生_______个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁发生腐蚀时,正极上发生的反应是 ( )
A.2Fe-4e- =2Fe2+ B.2Fe2++4e- =2Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
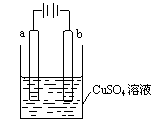
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是
A.若a和b为石墨,通电后b电极上发生的反应为Cu2++2e-=Cu
B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色
C.若a为铜,b为铁,通电后Cu2+向b电极移动
D.若a为粗铜,b为纯铜,通电后b电极质量增加
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.SiH4比CH4稳定
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5 518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+ (aq)+Ba2+(aq)+2OH-(aq)====BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)====BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
B.KOH(aq)+ H2SO4(aq)====
H2SO4(aq)==== K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
C.C8H18(l)+ O2(g)====8CO2(g)+9H2O(g);ΔH=-5 518 kJ/mol
O2(g)====8CO2(g)+9H2O(g);ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)====16CO2(g)+18H2O(l);ΔH=-5 518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于外围电子排布式为3s23p4的粒子描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
 C. 它的元素符号为O
C. 它的元素符号为O
D. 核外电子轨道表示式为 1s 2s 2p 3s 3p
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com