


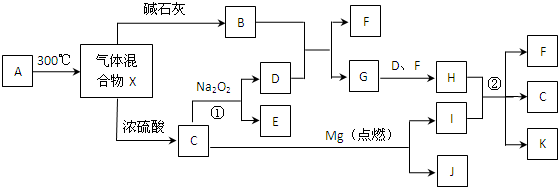
分析 B是金属单质,固体D为两性氧化物,二者均反应生成G,则B为Al,D为Al2O3,G为NaAlO2.A为红棕色固体,与B反应得到金属单质C与氧化铝,则A为Fe2O3,C为Fe,由E、F相互转化可知,F是FeCl2,E为FeCl3,H为红褐色沉淀,则H为Fe(OH)3,I为Fe(OH)2,据此解答.
解答 解:B是金属单质,固体D为两性氧化物,二者均反应生成G,则B为Al,D为Al2O3,G为NaAlO2.A为红棕色固体,与B反应得到金属单质C与氧化铝,则A为Fe2O3,C为Fe,由E、F相互转化可知,F是FeCl2,E为FeCl3,H为红褐色沉淀,则H为Fe(OH)3,I为Fe(OH)2.
(1)A的化学式为Fe2O3,故答案为:Fe2O3;
(2)B为Al,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)由于固体D(Al2O3)熔点、沸点高,所以常用于制造耐火材料,故答案为:耐火;
(4)检验FeCl3中阳离子的试剂为:KSCN溶液或NaOH溶液,故答案为:KSCN溶液或NaOH溶液;
(5)I生成H的化学方程式:4Fe(OH)2+O2+2H2O=4 Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3.
点评 本题考查无机物的推断,A、H的颜色为及B、D均与氢氧化钠反应等是推断突破口,需要学生熟练掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2NaOH+H2↑.
=2NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易生铜锈 | |
| B. | 生铁比软件铁芯(几乎是纯铁)容易生锈 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 银质奖牌久置后表面变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纤维增强复合材料可用于人体组织中韧带的制作 | |
| B. | 氮化硅陶瓷是新型无机非金属材料 | |
| C. | 银、铜、铁都是有色金属材料 | |
| D. | 碳化硅陶瓷具有压电效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)采用系统命名法:写出下列各烃的名称
(Ⅰ)采用系统命名法:写出下列各烃的名称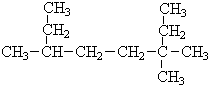 ,3,3,6-三甲基辛烷
,3,3,6-三甲基辛烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
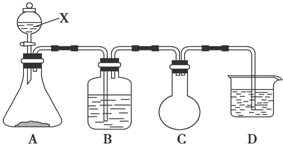
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com