
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
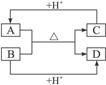
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
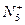 的盐类。Christe指出:
的盐类。Christe指出: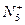 是远比
是远比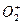 更强的氧化剂,跟水和有机物反应均发生爆炸。下列叙述错误的是( )
更强的氧化剂,跟水和有机物反应均发生爆炸。下列叙述错误的是( )A.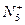 共有34个核外电子 共有34个核外电子 | B.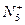 性质非常活泼 性质非常活泼 |
| C.化合物N5AsF6中As化合价为+1 | D.化合物N5AsF6中F化合价为-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | X | Y | Z |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |
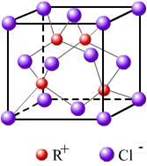
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com