
(12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
① ②
② ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。

(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
(1)①② ; (2)③④ ⑤; (3)④ ;(4)c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ;(5)中 ;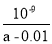
【解析】
试题分析:(1))稀释0.1mol·L-1氨水时 ,① ,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb=
,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb=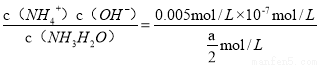 =
=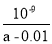 答案为
答案为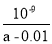
考点:电荷守恒、盐类的水解


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:2015界山东省高三第一次9月诊断性考试化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C离子的原子结构示意图_______________;D在周期表的位置___________________。
(2)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)________________,以下三种说法中,可以验证该结论的是(填写编号)______________;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素气态氢化物的稳定性
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),它们都含有的化学键类型是_________,这两种酸式盐在水溶液中相互反应的离子方程式为_______________________________。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,转移的电子数是___。
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.分解反应 B.置换反应 C.复分解反应 D.化合反应
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省绥化市三校高三上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下, 21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省绥化市三校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
常温时,① pH=2的CH3COOH溶液;② pH=2的HCl溶液;③ pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
A.由水电离的c(H+) :①=②=③=④
B.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
C.将②、③溶液混合后,若pH=7,则消耗溶液的体积:②> ③
D.四种溶液均稀释100倍后,溶液的pH:③> ④> ②> ①
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
已知热化学方程式:
①C2H2 (g)+5/2O2(g)=2CO2(g)+H2O(l) △H1= _1301.0kJ/mol
②C(s)+O2(g)=CO2(g) △H2= _393.5kJ/mol
③H2(g)+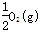 =H2O(l) △H3= _285.8kJ/mol
=H2O(l) △H3= _285.8kJ/mol
则反应④ 2C(s) + H2(g) = C2H2(g)的△H为
A.+621.7kJ/mol B.+1301.0kJ/mol C.-228.2kJ/mol D.+228.2 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高二上学期期中考试化学(文)试卷(解析版) 题型:填空题
下表是元素周期表的一部分,其中列出了①一⑥六种元素在周期表中的位置。
族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA |
2 |
|
|
| ① | ② | ③ |
|
3 | ④ |
| ⑤ |
|
| ⑥ | ⑦ |
请回答下列问题:
(1)⑤的元素符号为 ,①与③形成的酸性氧化物电子式 。
(2)④和⑦两元素形成的化合物的化学式为 ,焰色反应为 色。
(3)单质⑦制备漂白液的化学方程式 。
(4)④在空气中燃烧的生成物的化学式 ,其颜色是 色。
(5)Cu与②的最高价氧化物的水化物的稀溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高三第一次月考化学试卷(解析版) 题型:选择题
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com