

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
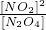 ,故答案为:
,故答案为: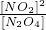 ;
;
 .
.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:阅读理解

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
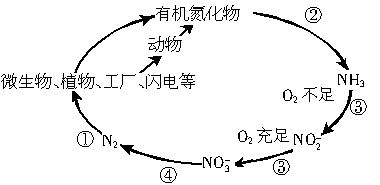
自然界中氮的循环涉及到地球上生物圈的方方面面。人类进入工业化社会以后,化学合成氮肥的数量迅速上升,对氮的循环和环境影响很大。下图是工业合成氮肥的转化关系:
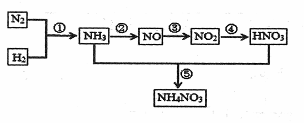
回答下列问题:
(1)反应①的条件是 ,反应④的化学方程式为 ,
反应⑤所得产物的溶液中离子浓度由大到小得顾序为 。
(2)实验室制取NH3的一种方法是在生石灰中滴加浓氨水,其原因是
。
(3)硝酸厂的尾气含有氮的氧化物,直接排放将污染空气。目前科学家探索利用燃料
气体中的CH4等将氮的氧化物还原为N2和H2O,反应原理为:
![]()
![]()
则![]() 直接将NO2还原为N2的热化学方程式为 。 .
直接将NO2还原为N2的热化学方程式为 。 .
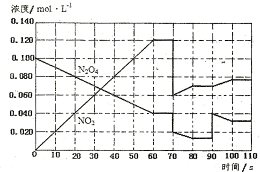
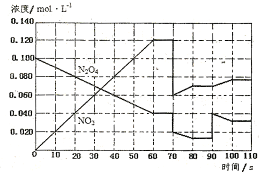
(4)下图表示某温度时,反应N2O4(g)![]() 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
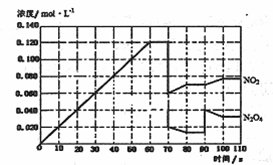
①此反应的平衡常数表达式K= 。
②反应进行到70s时,改变的条件可能是 (填字母) , 反应进行到90s时,改变的条件可能是 (填字母)
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大N2O4的浓度
③请在图中画出反应物N2O4在0~70秒时的浓度变化曲线。
查看答案和解析>>
科目:高中化学 来源:2011年山东省烟台市高考化学适应性练习试卷(一)(解析版) 题型:解答题

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com