
分析 已知:①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1,依据盖斯定律将(①×2-②)÷2得到CO与Sx生成COS反应的热化学方程式.
解答 解:①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;
②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1,
依据盖斯定律(①×2-②)÷2得到:CO(g)+$\frac{1}{x}$Sx(s)=COS(g)△H=$\frac{a-b}{2}$KJ/mol,
故答案为:CO(g)+$\frac{1}{x}$Sx(s)=COS(g)△H=$\frac{a-b}{2}$KJ/mol.
点评 本题考查盖斯定律计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握盖斯定律的应用,把握计算思路.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
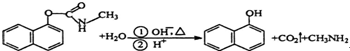
| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
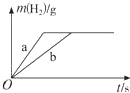
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
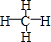 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
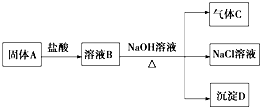
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com