
| X | ||||
| Y | Z | |||
| W |
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、Z的氢化物有可能含非极性键 | |
| C. | Z、W形成的化合物W显负价 | |
| D. | Y分别与Z、W形成的化合物全部都是非极性分子 |
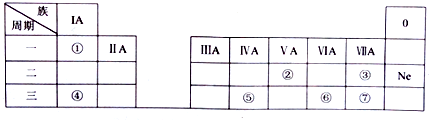
分析 由短周期元素X、Y、Z、W在元素周期表中的相对位置,可知X为He、Y为C、Z为O、W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.Y的氢化物C2H6等、Z的氢化物H2O2均含有非极性键;
C.氯元素氧化物中氧元素表现负化合价;
D.CO属于极性分子.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的相对位置,可知X为He、Y为C、Z为O、W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:r(W)>r(Y)>r(Z),故A错误;
B.Y的氢化物C2H6等、Z的氢化物H2O2均含有非极性键,故B正确;
C.氯元素氧化物中氯元素表现正化合价、氧元素表现负化合价,故C错误;
D.Y分别与Z、W形成的化合物有CO、二氧化碳、四氯化碳等,其中CO属于极性分子,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律应用,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:多选题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第三周期、VIIA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | 甲和丙分子均只含极性键 | |
| D. | A、B、C、D四种元素中的三种能形成多种与甲分子等电子数的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 讲盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| B | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向饱和Na2CO3溶液中通入足量的CO2 | 溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| D | 向氯水中滴加紫色石蕊试剂 | 溶液变红 | 氯水显酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.
能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 实验室点燃H2前,应先检验气体纯度 | |
| C. | 氯水与亚硫酸钠溶液的混合液,漂白性更强 | |
| D. | 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b=1:1 | |
| B. | Y为OH- | |
| C. | 氧化性为:SeO2>H2SO4(浓) | |
| D. | 若每生成0.2molX则该反应转移0.4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.074 | 0.099 | 0.110 | 0.160 | 0.077 |
| 主要化合价 | -2 | +7、-1 | +5,-3 | +2 | +4、-4 |
 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com