
 (2009?肇庆一模)下列涉及有机物的性质或应用的说法错误的是( )
(2009?肇庆一模)下列涉及有机物的性质或应用的说法错误的是( )

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步聚 | 实验操作 | 预期现象和结论 |
| 第一步 | 取适量样品粉末于的试管中,加入过量的 2mol/LNaOH溶液,并不断振荡试管 取适量样品粉末于的试管中,加入过量的 2mol/LNaOH溶液,并不断振荡试管 |
试管中固体减少,溶液无色 试管中固体减少,溶液无色 |
| 第二步 | 装配好过滤装置,过滤试管中的溶液,滤液和滤渣分别置于不同试管中备用 装配好过滤装置,过滤试管中的溶液,滤液和滤渣分别置于不同试管中备用 |
---- ---- |
| 第三步 | 取滤渣于另外的试管中,滴入1mol/L稀硫酸,再向其中滴入2~3滴10%KSCN溶液 取滤渣于另外的试管中,滴入1mol/L稀硫酸,再向其中滴入2~3滴10%KSCN溶液 |
若滴入KSCN溶液后试液变红,则说明固体中含有Fe2O3 若滴入KSCN溶液后试液变红,则说明固体中含有Fe2O3 |
| 第四步 | 取滤液逐滴滴入1mol/L稀硫酸直至略过量,再向其中滴入浓氨水直至过量 取滤液逐滴滴入1mol/L稀硫酸直至略过量,再向其中滴入浓氨水直至过量 |
滴入稀硫酸时先有白色沉淀,然后白色沉淀溶解;再滴入氨水时有白色沉淀生成且部分溶解,说明粉末中含有ZnO 滴入稀硫酸时先有白色沉淀,然后白色沉淀溶解;再滴入氨水时有白色沉淀生成且部分溶解,说明粉末中含有ZnO |
查看答案和解析>>
科目:高中化学 来源: 题型:
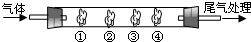
| B中棉花的位置 | ① | ② | ③ | ④ |
| 棉花浸取试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
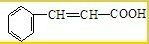
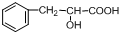 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:




查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com