
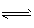 2C3 (g)△H= -Q1kJ·mol-1(Q1>0),在-个有催化剂的固定容积的容器中加入2mol A和1mol B2,在500℃时充分反应,达平衡后C3的浓度为ωmol·L-1,放出热量Q2kJ。
2C3 (g)△H= -Q1kJ·mol-1(Q1>0),在-个有催化剂的固定容积的容器中加入2mol A和1mol B2,在500℃时充分反应,达平衡后C3的浓度为ωmol·L-1,放出热量Q2kJ。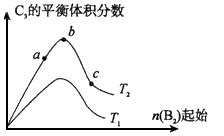
科目:高中化学 来源: 题型:
(12分)已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
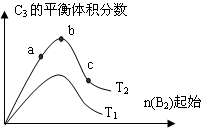 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省泗阳致远中学高三实验班第一次模拟考试化学试卷(带解析) 题型:填空题
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: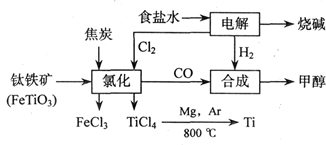
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应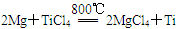 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省五校协作体高三上学期期初考试化学试卷(解析版) 题型:填空题
已知2A2(g)+B2(g)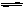 2C(g);△H= -a
kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H= -a
kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是 (填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三实验班第一次模拟考试化学试卷(解析版) 题型:填空题
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
A.v(C3)=2v(B2) B.容器内压强保持不变
C.v逆(A2)=2v正(B2) D.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源:湖北省2010-2011学年高三年级十月月考化学试题 题型:填空题
(12分)已知2A2(g)+B2(g)
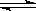 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com