
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且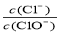 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A.若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=1/2
B.参加反应的氯气的物质的量等于1/2amol
C.改变温度,产物中KC1O的最大理论产量为1/2 amol
D.改变温度,产物中KC1O3的最大理论产量为1/7amol
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
欲配制100 mL 1.0 mol/L Na2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100 mL水中
② 将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL
③ 将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
已知 NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
A.NH4CuSO3中硫元素被氧化了
B.该反应中NH4CuSO3既是氧化剂又是还原剂
C.刺激性气味的气体是二氧化硫或氨气
D.该反应中硫酸既表现为酸性又表现氧化性
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学卷(解析版) 题型:选择题
下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、苯酚、硝基苯 B.苯、乙醛、乙烯
C.甲酸、甲苯、乙酸 D.苯乙烯、乙苯、环己烷
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数,下列说法正确的是
①25℃时,pH=12的1.0LNaClO溶液中水电离出的OH-的数目为0.01NA
②1.0L1.0mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
③46gNO2和N2O4的混合气体所含氧原子数为2NA
④标准状况下,22.4LCH2Cl2含有的分子数为NA
⑤将NA个NH3分子溶于1L水中得到1mol·L-1的氨水
⑥1molSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
A.①②③⑥ B.①③ C.②④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第二次月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键
B.甲烷和乙烯都可以与氯气反应,且反应类型相同
C.用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
D.氨基酸分子中均含有羧基(-COOH)和氨基(-NH2)
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第二次月考化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓
B.向澄清的石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.向Al2(SO4)3溶液中加入过量氨水溶液:Al3+ +3NH3·H2O =Al(OH)3↓+3NH4+
D.向Ca(ClO)2溶液中通入SO2: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三10月月考化学卷(解析版) 题型:选择题
下表各组物质中,不能通过一步反应实现如图所示转化的是
选项 | X | Y |
|
A | Fe | FeCl3 | FeCl2 |
B | NH4Cl | NH3 | NO |
C | CO | CO2 | |
D | Al2O3 | AlCl3 | Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一上第一次月考化学试卷(解析版) 题型:选择题
某学生想利用所学的知识去探究Br2的性质,设计了如下研究程序,合理的是( )
A.实验→分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→比较并得出结论
B.分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→实验→比较并得出结论
C.观察(得出Br2的物理性质)→实验→分类(预测Br2的化学性质)→比较并得出结论
D.观察(得出Br2的物理性质)→分类(预测Br2的化学性质)→实验→比较并得出结论
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com