
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):

计算H2(g)+ Br2(g)===2HBr(g)的反应热 ( )
A. +103 kJ·mol-1 B. +679 kJ·mol-1
C. -103 kJ·mol-1 D. +183 kJ·mol-1
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验过程的评价,正确的是( )
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO![]()
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.验证某溶液中是否含有Cl-,先加稀硝酸酸化,再加入AgNO3溶液,有白色沉淀,证明含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的氧气和臭氧其物质的量之比为___,原子个数之比为__。
(2)标准状况下,36.5gHCl气体的体积约为___。将该气体溶于水中得到2L溶液,则该溶液的浓度为____。
(3)质量分数为w的MgCl2溶液,密度为dg/mL,该溶液中氯离子的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取0.1mol·L-1HY溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法正确的是
A. 混合溶液中由水电离出的c(OH-)=1×10-9mol/L
B. 混合溶液中离子浓度由大到小的顺序为c(Y-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C. 混合溶液中c(OH-)-c(HY)= c(H+)=1×10-9mol/L
D. 混合溶液中c(Na+)=c(Y-)+c(HY)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LHF含分子数目为0.1NA
B. 120 g NaHSO4固体含有H+的数目为NA
C. 100mL0.1mol/L的Na2CO3溶液中,含阴离子的数目大于0.01NA
D. 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种有机化合物的转换关系:

请回答下列问题:
(1)根据系统命名法,化合物A的名称是__________。
(2)上述框图中,①是__________反应,③是__________反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:______________________。
(4)C2的结构简式是_________________________________,F1的结构简式是__________________________________________,F1和F2互为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应:X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时Y和Z的生成速率之比为2∶3
C. X、Y的转化率之比为1:3
D. c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:P4(s)+6Cl2(g)![]() 4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)
4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)![]() 4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
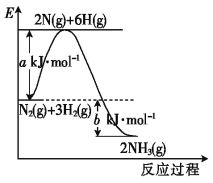
(2)工业合成氨时,合成塔中每生成1molNH3放出46kJ的热量。其反应过程的能量变化如图。b值为________kJ。加入催化剂,a值____(填“增大”“减小”或“不变”,下同)。压缩容器体积,b值___。
(3)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com