
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
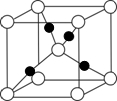
 (5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
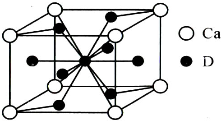
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
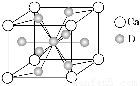
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省宜春市高三4月模拟考试理综化学试卷(解析版) 题型:推断题
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。F原子的一种核素的质量数为65,中子数为 36。请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个。
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
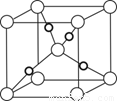
(6)在F的+1价氧化物的晶胞结构如图,F为 球(“黑”“白”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com