
分析 (1)工业中,从合成塔出来的混合气体成分是NH3、H2、N2;在进入分离器之前,需进入冷却塔;
(2)根据可逆反应的特点分析解答;
(3)氨气在工业制备硝酸生产中的作用氨气与氧气反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;由反应方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾气生成1mol的二氧化碳,所以每吸收5mol尾气,则生成CO2的物质的量为2.5mol;
(4)尿素与NO2反应生成氮气和二氧化碳气体,反应的方程式为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
解答 解:(1)工业中,从合成塔出来的混合气体成分是NH3、H2、N2;在进入分离器之前,需进入冷却塔,故答案为:NH3、H2、N2;冷却塔;
(2)根据可逆反应不可能完全转化,如果3mol氢气完全转化生成2mol的氨气,所以生成的氨气的物质的量小于2mol,故选a;
(3)氨气在工业制备硝酸生产中的作用氨气与氧气反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;由反应方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾气生成1mol的二氧化碳,所以每吸收5mol尾气,则生成CO2的物质的量为2.5mol,故答案为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;2.5mol;
(4)尿素与NO2反应生成氮气和二氧化碳气体,反应的方程式为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O,故答案为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
点评 本题考查了含氮物质的应用,题目难度中等,明确工业制取硝酸的原理为解答关键,注意掌握含氮物质的性质及综合应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
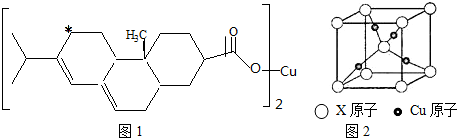
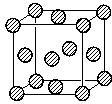 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
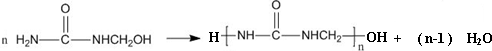
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 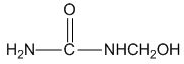 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com