
| A. | 向苯酚中加浓溴水观察沉淀 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
分析 A.苯酚和浓硝酸发生取代反应生成白色沉淀;
B.银镜反应的条件是水浴加热;
C.苯和液溴在溴化铁作催化剂条件下发生取代反应;
D.乙醛和新制氢氧化铜的悬浊液反应必须在碱性条件下.
解答 解:A.苯酚和浓硝酸发生取代反应生成白色沉淀三溴苯酚,所以向苯酚中加浓溴水观察沉淀,故A正确;
B.银镜反应的条件是水浴加热,不能直接加热,故B错误;
C.苯和液溴在溴化铁作催化剂条件下发生取代反应,苯和溴水不反应,故C错误;
D.乙醛和新制氢氧化铜的悬浊液反应必须在碱性条件下,该实验中氢氧化钠不足,溶液呈酸性,所以不能实现实验目的,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及实验反应条件及实验试剂的选取,明确实验原理及物质性质是解本题关键,注意常见反应条件及反应现象,易错选项是CD.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
 .
.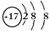 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
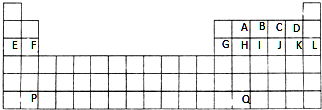
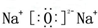 .F的原子结构示意图为
.F的原子结构示意图为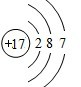 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
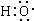
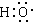 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

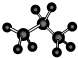
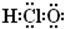
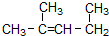 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.摩尔是化学上常用的一个物理量
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列关于实验基本操作的叙述,不正确的是
A. 用蒸发皿进行加热蒸发时,不需要垫加石棉网即可直接进行加热
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生局部过热而暴沸
C. 蒸馏时,冷凝水应从冷凝管上口进,下口出
D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com