
(9分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示
(图中的ΔH表示生成lmol产物的数据)。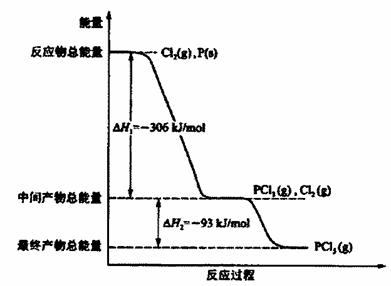
根据上图回答下列问题:
(1) PCl5分解成PCl3 和Cl2的热化学方程式是________ ______;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PC15,反应达平衡时PC15还剩0.60 mol,其分解率α1等于________;若反应温度由Tl升高到T2,平衡时PC15的分解率α2为,α2_______α1(填“大于”、“小于”或“等于”) ;
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是_______________________________________________
(3)P和Cl2分两步反应生成1molPCl5的ΔH3 =_____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4___________ΔH3;(填“大于”、“小于”或“等于”)
( 1 ) PCl5(g)==PCl3(g)+Cl2(g) △H=+93kJ/ lmol 25% (2分) 大于(1分)
(2)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(3)-399kJ/ mol(1分) 等于 (1分)
解析试题分析:(1)五氯化磷的分解过程是吸热的过程,根据图中数据,可得:PCl5(g)═PCl3(g)+Cl2(g),△H=+93kJ/lmol,
所以该反应的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g),△H=+93kJ/lmol。分解率是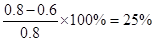 ,由于正反应是吸热反应,所以升高温度,平衡向正反应方向移动,PCl5的分解率增大,即α2大于α1。
,由于正反应是吸热反应,所以升高温度,平衡向正反应方向移动,PCl5的分解率增大,即α2大于α1。
(2)P和Cl2反应生成中间产物PCl3以及三氯化磷和氯气反应生成五氯化磷这两步反应均为放热反应,生成三氯化磷后降温,再和Cl2反应生成PCl5,这样有利于提高产率,防止产物分解,所以正确的为:两步反应均为放热反应,降温有利于提高产率,防止产物分解。
(3)根据图中数据,可得P(s)+Cl2(g)=PCl5(g)△H3=-306 kJ/mol -93 kJ/mol =-399kJ/mol,根据盖斯定律可知,P和Cl2一步反应生成1molPCl5的焓变和分步反应生成的焓变是相等的,则△H3=△H4=-399kJ/mol。
考点:考查热化学方程式的书写、转化率的计算以及盖斯定律的应用
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大,有利于培养学生分析问题、解决问题的能力,特别是根据图像进行的问题分析,有助于培养学生的逻辑思维能力和灵活应变能力。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2014届黑龙江省高二上学期期末考试化学试卷(解析版) 题型:填空题
(9分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示
(图中的ΔH表示生成lmol产物的数据)。
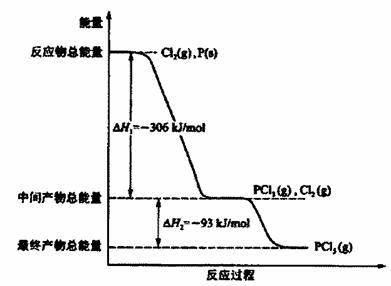
根据上图回答下列问题:
(1) PCl5分解成PCl3 和Cl2的热化学方程式是________ ______;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PC15,反应达平衡时PC15还剩0.60 mol,其分解率α1等于________;若反应温度由Tl升高到T2,平衡时PC15的分解率α2为,α2_______α1(填“大于”、“小于”或“等于”) ;
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是_______________________________________________
(3)P和Cl2分两步反应生成1molPCl5的ΔH3 =_____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4___________ΔH3;(填“大于”、“小于”或“等于”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com