
分析 (1)根据纯水中c(OH-)=c(H+),溶液显示中性进行分析;
根据该温度下纯水中氢离子浓度和氢氧根离子浓度,计算出水的离子积,根据水的离子积计算出溶液中氢氧根离子的浓度,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
(2)醋酸钠溶液中,醋酸根离子部分水解,溶液呈碱性,则c( OH-)>c(H+),再结合电荷守恒判断钠离子和醋酸根离子浓度大小;
(3)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸;
(4)0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量;
(5)根据中和热的定义计算反应热;
(6)依据热化学方程式和盖斯定律计算得到热化学方程式.
解答 解:(1)纯水显示中性,c(OH-)=c(H+)=5.0×10-7mol/L;
此温度下,水的离子积为:Kw=5.0×10-7×5.0×10-7=2.5×10-13,
溶液中氢离子浓度c(H+)=5.0×10-3mol/L,c(OH-)=$\frac{2.5×1{0}^{-13}}{5.0×1{0}^{-3}}$mol/L=5.0×10-11 mol/L,
酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,由水电离出的c(H+)=5.0×10-11 mol/L,故答案为:5.0×10-7mol/L;5.0×10-11mol/L;
(2)在CH3COONa的溶液中,醋酸根离子部分水解,溶液显示碱性,则c( OH-)>c(H+),根据电荷守恒可知:c( Na+)>c(CH3COO-),水解很弱,则溶液中离子浓度大小为:c( Na+)>c(CH3COO-)>c( OH-)>c(H+);
(3)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故答案为:Al3++3H2O?Al(OH)3+3H+;
(4)0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量,热化学反应方程式为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1,故答案为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1;
(5)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,则生成1mol水放出57.3kJ的热量,
反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(6)已知①N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7KJ/mol;故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7KJ/mol.
点评 本题考查了水的离子积常数的有关计算,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
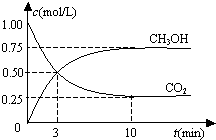 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时升高了温度 | |
| B. | t3时降低了温度 | |
| C. | t5时增大了压强(缩小容器体积) | |
| D. | 平衡状态时,t6时刻Z的百分含量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟甲基(-CH2OH)和甲氧基(-OCH3) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2-) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟基(-OH)和氢氧根(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①、③均属于取代反应 | B. | 反应②、④均属于氧化反应 | ||
| C. | 加入酸性K2Cr2O7溶液可实现反应⑤ | D. | 加入NaOH溶液可实现反应⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6Hl0O5)n+nH2O$\frac{\underline{\;催化剂\;}}{\;}$nC6H12O6 淀粉(或纤维素) 葡萄糖 | |
| B. | CH3COOH+CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O | |
| C. | CH2=CH2+Br2$\stackrel{CCl_{2}}{→}$CH2BrCH2Br | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=10-13mol•L-1的溶液中:Na+、NH4+、Cl-、NO3- | |
| B. | 1.0 mol•L-1KI溶液中:Mg2+、Fe2+、SO42-、ClO- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、NH4+、HCO3-、I- | |
| D. | 饱和氨水中:NH4+、Ag+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com