
【题目】下列过程中,能观察到明显现象的是( )
A. 在稀盐酸中滴加NaOH溶液
B. 在AlCl3溶液中滴加NaOH溶液
C. 在NaHCO3溶液中滴加NaCl溶液
D. 在FeCl2溶液中滴加少量H2O2后,再滴加KSCN溶液
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1molL-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )

A. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 该温度下醋酸的电离平衡常数为10-4.75
C. pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1molL-1
D. 向W点所表示的溶液中加入等体积的0.05molL﹣1NaOH溶液:c(H+)=c(CH3COOH)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、II正确并且有因果关系的是 ( )
选项 | 陈述I | 陈述II |
A | 铝可以分别和NaOH溶液、盐酸反应 | 铝既有金属性又有非金属性 |
B | Na2CO3可以制胃药 | Na2CO3可以和盐酸反应 |
C | 硬铝是合金 | 其熔点比金属铝的熔点高 |
D | Na2O2具有强氧化性 | Na2O2可以作为漂白剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是
①道尔顿原子模型②汤姆生原子模型③卢瑟福原子模型④电子云模型
A.①③②④B.④①②③C.④②③①D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子最外层电子数为次外层电子数的3倍。E与D位于同一主族。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体。
回答下列问题:
(1) 基态E原子的价电子排布图为_____________________。
(2) 形成化合物Y的五种元素中第一电离能最大的是__________;电负性最大的是________(填元素符号)。
(3) 化合物X中心原子的杂化方式为________,X分子中的两种键角的大小关系是_________________(用∠XYZ表示,X、Y、Z代表元素符号)。
(4) C2D分子的立体结构为________________;A分别与B、C形成的简单化合物熔、沸点由高到低顺序为________(用化学式表示),简单说明原因_________________。
(5) 晶体Y中存在的化学键类型有_____________________。(填代号)
A、离子键 B、非极性共价键 C、配位键 D、氢键 E、σ键 F、金属键
(6) 下图是D、F两种元素形成的化合物的晶胞结构示意图,F的配位数是_______________;已知晶胞中最近的两个D原子间距离为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是
A. l00mL1mol/LNa2SO4溶液中溶质离子总数为0.3NA
B. 常温下,22.4LH2O含有10NA个电子
C. 常温下,46gNO2和N2O4的混合气体中含有的氮原子数目为NA
D. 若120g石墨能写a个字,则平均每个字约含有![]() 个碳原子
个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖分解代谢的叙述,错误的是
A. 甜菜细胞中的蔗糖经水解可产生葡萄糖和果糖
B. 各种糖类都可以氧化分解,为细胞供能
C. 发芽小麦种子中的麦芽糖经水解可产生葡萄糖
D. 纤维素经微生物水解可产生葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,硫的某种含氧酸H2SOx(x≤4)与H2S可发生如下反应:H2S+H2SOx—S+(x-3)SO2+H2O(未配平)下列推断合理的是
A. 该反应中,一定有SO2 B. 该反应中,H2S作还原剂,H2SOx作氧化剂
C. 若x=3,则还原剂与氧化剂的物质的量之比为1:1 D. 若x=4,每生成1molS,转移的电子为6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式:_________________________,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇过程中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
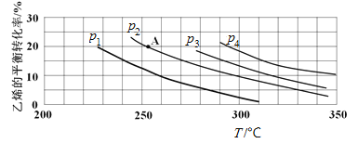
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________,理由是________________;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________(任写两条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com