
| A�������£�pH��4�Ĵ����pH��10������������Һ�������ϣ���pH> 7 |
| B��pH��3��������pH��11�İ�ˮ�������Ϻ���Һ�У� c��NH4+����c��Cl-����c��OH-����c��H+�� |
| C�����ʵ���Ũ����ȵ�NH4Cl��Һ��NH4HSO4��Һ�У�NH4+Ũ����� |
D������AgI����������Һ�еμ� NaCl��Һ�����Թ۲쵽��ɫ�������� NaCl��Һ�����Թ۲쵽��ɫ�������� |
 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪���������ȶ���С���춡�飬��CH3CH2CH2CH3(g)��(CH3)2CHCH3(g)����H>0 |
B����֪�� OH-(ag)+H+(aq)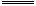 H2O(l)����H="-57.4" kJ/mol H2O(l)����H="-57.4" kJ/mol ��20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ�������� |
C����֪��2H2O(l) 2H2(g)+O2(g)����H=" +483.6" kJ�� mol��1����������ȼ����Ϊ241.8kJ/mol 2H2(g)+O2(g)����H=" +483.6" kJ�� mol��1����������ȼ����Ϊ241.8kJ/mol |
| D����֪��2C(s)+2O2(g)=2CO2(g)����H12C(s)+O2(g)=2CO(g)����H2�����H1>��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ԭ�����Һ�е�CO2-3��AlO��2�����ʵ���֮��Ϊ1:2 |
| B��V1��V2=l��5 |
| C��M��ʱ���ɵ�CO2Ϊ0.05mol |
| D��a���߱�ʾ�����ӷ���ʽΪ��AlO��2+H++H2O=Al(OH)3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B��С�� | C������ | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=2��pH=l��������c��H+��֮��Ϊ10��1 |
| B��һԪ����һԪ��ǡ����ȫ��Ӧ�����Һ��һ������c��H+��=c��OH-�� |
| C��KAl��SO4��2��Һ������Ũ�ȵĴ�С˳��Ϊc��SO2-4��>c��K+��>c��Al3+��>c��H+��>c��OH-�� |
| D�������£���pH��Ϊ12�İ�ˮ��NaOH��Һ�ֱ��ˮϡ��100����NaOH��Һ��pH�ϴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ���Ȼ�淋Ļ��Һ����pH=7ʱ��c��Clһ��>C��NH4+�� |
| B��pH=2��һԪ���pH=12��NaOH��Һ��������,���Һ��C��H+��һ�� ����C��OH-�� |
| C��0.1mol��L��Na2S��Һ�У�C��OH����=c��H+��+C��HS����+2C��H2S�� |
| D��0.1mol��LNaCl��Һ��0.1mol/LNaF��Һ����������Ũ��һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
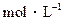 ��CH3COONa��Һ��0.1
��CH3COONa��Һ��0.1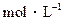 ��HCl��Һ�������Ϻ���Һ�������������ʵ���Ũ�ȵĹ�ϵ�У���ȷ����
��HCl��Һ�������Ϻ���Һ�������������ʵ���Ũ�ȵĹ�ϵ�У���ȷ����| A��[CH3COO��] = [Cl��] = [H+] > [CH3COOH] |
| B��[CH3COO��] = [[Cl��] > [CH3COO��] > [H+] |
| C��[CH3COO��] > [Cl��] > [H+] > [ CH3COOH] |
| D��[CH3COO��] > [Cl��] > [ CH3COOH] > [H+] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1 mol/L NH4Cl��Һ�м���NH 3��H2O ��������ʱ��c(NH4�� )��c(Cl��) |
| B��0.1 mol/L Na2CO3��Һ�У�c(OH��)��c(H��)��c(HCO3��)��2c(H2CO3) |
| C������������Һ�еμ�ϡ����õ���pH��3�Ļ����Һ�У�c(Na��)��c(NO3)�� |
| D��CH3COONa��Һ�м�������CH3COOH���������Ի����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��C(Na+)>C(CO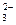 )>C(HCO )>C(HCO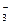 )>C(OH-)>C(H+) )>C(OH-)>C(H+) |
B��2C(Na+)=3[C(CO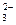 )+C(HCO )+C(HCO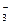 )+C(H2CO3)] )+C(H2CO3)] |
C��2C(OH-)+C(CO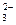 )=C(HCO )=C(HCO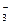 )+3C(H2CO3)+2C(H+) )+3C(H2CO3)+2C(H+) |
D��C(Na+)+C(H+)=C(OH-)+C(HCO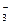 )+2C(CO )+2C(CO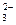 ) ) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com