
研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
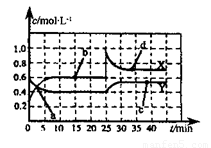
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。

(每空2分,共14分)(1)NO和NO2 (2)Y; (c)=
(c)= (d)>
(d)> (b);增大NO2的浓度
(b);增大NO2的浓度
(3) ×10-3mol/L(少单位扣1分)
(4)-1200kJ/mol(少单位扣1分,少“-”扣1分)
×10-3mol/L(少单位扣1分)
(4)-1200kJ/mol(少单位扣1分,少“-”扣1分)
(5)N2O4+2HNO3 2N2O5+H2↑
2N2O5+H2↑
【解析】
试题分析:(1)根据反应的方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,因此氨气是还原剂。NO和NO2中氮元素的化合价分别从+2价和+4价降低0价,得到2个和4个电子,因此氧化剂是NO和NO2。
(2)由图可知10~25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6=0.4)mol/L=0.2mol/L。即X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;由图可知,10~25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,因此c和d点的反应速率相等。25min后NO2和N2O4的浓度增大,因此反应速率增大,即b、c、d三点的化学反应速率大小关系是 (c)=
(c)= (d)>
(d)> (b);根据图像可知,25min时NO2的浓度瞬间增大,而N2O4的浓度逐渐增大,所以25min时,曲线发生图中变化,可采取的措施是增大NO2的浓度。
(b);根据图像可知,25min时NO2的浓度瞬间增大,而N2O4的浓度逐渐增大,所以25min时,曲线发生图中变化,可采取的措施是增大NO2的浓度。
(3)氨水溶液中测得pH=11,因此溶液中c(OH-)=0.001mol/L,则根据电离方程式NH3·H2O OH-+NH4+可知,溶液中c(NH4+)=0.001mol/L,则溶液中c(NH3·H2O)=0.1mol/L-0.001mol/L,所以该温度下氨水的电离常数Kb=
OH-+NH4+可知,溶液中c(NH4+)=0.001mol/L,则溶液中c(NH3·H2O)=0.1mol/L-0.001mol/L,所以该温度下氨水的电离常数Kb= =
=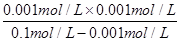 =
= ×10-3mol/L。
×10-3mol/L。
(4)已知反应①:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;②:2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;③:2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;④:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol,依据盖斯定律可知,(④×2-③)×2-①-②即得到反应式4CO(g)+2NO2(g)=4CO2 (g)+ N2(g),所以该反应的反应热△H=(-393.5kJ/mol×2+221kJ/mol)×2-180kJ/mol+112kJ/mol=-1200kJ/mol。
(5)电解池中阳极失去电子,发生氧化反应。阴极得到电子,发生还原反应。则阴极是溶液中的氢离子得到电子生成氢气,阳极是N2O4失去电子生成N2O5,所以总的反应式是N2O4+2HNO3 2N2O5+H2↑。
2N2O5+H2↑。
考点:考查氧化还原反应的有关判断;平衡状态的判断以及外界条件对反应速率和平衡状态的影响;电离常数的计算;盖斯定律以及电解原理的有关应用等


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?烟台一模)氮及其化合物在工农业生产中具有重要作用.
(2013?烟台一模)氮及其化合物在工农业生产中具有重要作用.| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省烟台市高三3月诊断考试化学试卷(解析版) 题型:填空题
氮及其化合物在工农业生产中具有重要作用。
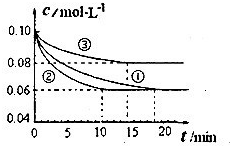
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g)
△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol
N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)
△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol
N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是
(填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是
(填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 2H2O(g) △H=-483.6kj/mol
2H2O(g) △H=-483.6kj/mol  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol  4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol  2N2(g)+6H2O(g)的△H=___________。如图是在一个密闭容器内,在催化剂作用下,一定量的氨气与氧气的混合气体在不同温度时的生成物及生成物含量与温度的关系图:温度较低时以反应_______(选填上述已知反应序号“①、②、③或④”)为主,当温度高于900℃时,NO产率下降的原因____。
2N2(g)+6H2O(g)的△H=___________。如图是在一个密闭容器内,在催化剂作用下,一定量的氨气与氧气的混合气体在不同温度时的生成物及生成物含量与温度的关系图:温度较低时以反应_______(选填上述已知反应序号“①、②、③或④”)为主,当温度高于900℃时,NO产率下降的原因____。 
 2NO2的化学平衡常数K=________。
2NO2的化学平衡常数K=________。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com